從基因的角度解析心血管疾病風(fēng)險(二)細(xì)說膽固醇
By 沈驪 GB HealthWatch

第二章:細(xì)說膽固醇
毫無疑問高膽固醇是心血管疾病的罪魁禍?zhǔn)祝B我們壽命的長短也很大程度取決于我們血液中膽固醇的高低。大家可能恨透了膽固醇,很多健康食品專門標(biāo)識 “不含膽固醇” ,營養(yǎng)專家也經(jīng)常告誡大家不要吃太多豬肝,蛋黃,奶酪等,因?yàn)檫@些食品膽固醇含量最高。其實(shí)膽固醇本身并不是壞人,相反,是我們身體中很重要的生物分子。身體中膽固醇含量最高的器官分別是大腦,肝臟,腎上腺素,性腺和皮膚,這些器官都需要大量的膽固醇供運(yùn)才能正常運(yùn)作,可見沒有膽固醇人是活不了的。
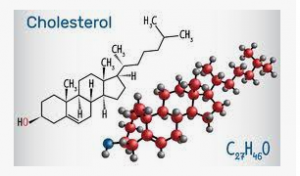
圖1. 膽固醇分子的結(jié)構(gòu)
細(xì)胞膜的” 鋼筋“,思想的”鋼筋“
膽固醇是細(xì)胞膜的重要組成成份,它和磷脂一起組成雙層磷脂細(xì)胞膜結(jié)構(gòu)。細(xì)胞膜中膽固醇與磷脂的比例,決定細(xì)胞膜的流動性;膽固醇比例越高,細(xì)胞膜流動性就越低,越能保持堅(jiān)挺的細(xì)胞形狀;相反膽固醇比例越低,細(xì)胞膜的流動性越高,細(xì)胞的形狀就只能是圓球形。膽固醇分子的結(jié)構(gòu)僵硬死板特別適合在細(xì)胞膜中起支撐和固定作用。所有動物細(xì)胞都依賴膽固醇分子維持細(xì)胞膜的強(qiáng)度和形狀。微生物和植物細(xì)胞不含膽固醇,所以必須依賴細(xì)胞壁外殼維持細(xì)胞的型狀。這也是為什么所有動物食品都含膽固醇而所有植物食品都不含膽固醇。在細(xì)胞膜上,膽固醇有點(diǎn)像鋼筋混泥土里的鋼筋,由膽固醇組成的脂肪與細(xì)胞內(nèi)的“骨架”蛋白一起支撐起動物細(xì)胞的各種形狀。如果沒有膽固醇,動物細(xì)胞和器官都只能是圓乎乎的一團(tuán)。膽固醇相對磷脂的比例越高,細(xì)胞膜就越硬扎有型。比如紅血球長得像甜甜圈,為了支撐起甜甜圈的形狀,紅血球細(xì)胞膜中膽固醇含量大約是圓型細(xì)胞的三倍。膽固醇對磷脂比例最高的細(xì)胞膜是神經(jīng)細(xì)胞膜,正是因?yàn)榇罅康哪懝檀肌颁摻睢霸谏窠?jīng)細(xì)胞膜中才能支撐起神經(jīng)網(wǎng)絡(luò)層層疊疊的有序連線,才可能形成動物的大腦,也因此才可能產(chǎn)生人類的思想。可見沒膽固醇的微生物和植物都不可能長出大腦和思想來。大腦是我們身體中膽固醇含量最高的器官。因?yàn)槟懝檀紝Υ竽X實(shí)在是太重要了,以致于大腦根本不放心把膽固醇供運(yùn)鏈交給飲食和肝臟掌管,而要全權(quán)控制大腦中膽固醇的自主合成。飲食攝入以及肝臟合成的膽固醇都幾乎不能進(jìn)入大腦。在大腦中負(fù)責(zé)膽固醇運(yùn)輸?shù)腁POE基因E4變異是迄今為止發(fā)現(xiàn)的老年癡呆癥風(fēng)險相關(guān)性最高的變異;攜帶有一條E4變異癥風(fēng)險增加2-3倍,而攜帶二條E4變異,風(fēng)險增加10-15倍。APOE基因與老年癡呆癥的緊密關(guān)系從另一個角度佐證了膽固醇對大腦功能的重要性。
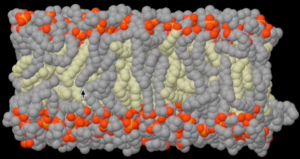
圖2. 雙層磷脂細(xì)胞膜模型中的膽固醇(黃色)
性欲的源泉,精力的源泉
膽固醇分子還是身體中各種甾體激素合成的起始底物。甾體激素包括我們大家熟悉的性激素,例如雄激素,雌激素和孕激素等。所有性激素都是以膽固醇為底物在性腺中合成的。當(dāng)膽固醇供應(yīng)不足時,就會缺乏性激素缺乏性欲,女人會停經(jīng)生不出孩子來。這也是為什么中國三年自然災(zāi)害時,因?yàn)槿馐硣?yán)重缺乏,幾乎沒有小孩出生。除了性激素外,另一大類甾體激素統(tǒng)稱腎上腺皮質(zhì)激素,由腎上腺合成,包括糖皮質(zhì)激素和鹽皮質(zhì)激素。糖皮質(zhì)激素就是我們經(jīng)常聽說的緊張激素可的松,負(fù)責(zé)調(diào)節(jié)身體中碳水化合物代謝,日晝平衡,應(yīng)激反應(yīng)和免疫系統(tǒng);鹽皮質(zhì)激素負(fù)責(zé)調(diào)節(jié)身體中鈉鉀平衡,維持血壓。如果糖皮質(zhì)激素和鹽皮質(zhì)激素不足,就會出現(xiàn)低血糖,低血壓,混身乏力,沒有精神。
除了性腺和腎上腺會消耗掉一小部分膽固醇外,膽固醇的兩個最大去處,一個是皮膚,另一個是在肝臟用于合成膽汁。膽固醇是皮膚角質(zhì)層的重要性組成部分,膽固醇不足皮膚會變得不保水粗糙容易感染生瘡。膽固醇也是合成維生素D的前體,曬太陽時陽光里的紫外線會將皮膚上的膽固醇分子轉(zhuǎn)化為維生素D。大部分膽固醇在肝臟被轉(zhuǎn)化成膽汁分泌到腸道,幫助消化吸收脂肪和脂溶性微生素。可見如果身體中沒有足夠的膽固醇供應(yīng),我們就會體無完膚,不能生育,不能生存。
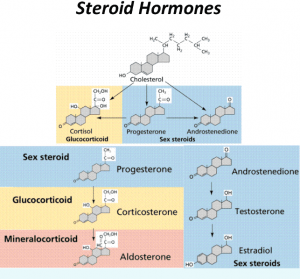
圖3. 以膽固醇為底物合成各種甾體激素
膽固醇供運(yùn)鏈
膽固醇對我們的身體如此重要,身體中必須有一整套系統(tǒng)來營運(yùn)膽固醇供運(yùn)鏈,以保障各器官對膽固醇的需求,其中肝臟是膽固醇供運(yùn)鏈的總調(diào)度,負(fù)責(zé)生產(chǎn),貯存,輸出和回收膽固醇。身體中的膽固醇部分來自食物,部分來自肝臟的自主合成。大腦中的膽固醇是個例外,全部由大腦自主合成,食物和肝臟自主合成的膽固醇都幾乎完全不能進(jìn)入大腦。我們前面講過微生物和植物都不含膽固醇,只有攝入動物食品才會獲取膽固醇。膽固醇含量高的食品包括蛋黃,動物內(nèi)臟以及皮膚。中國人喜歡的雞翅鴨掌豬腦花等小吃都是高膽固醇食品,另外海鮮里的螃蟹大蝦貝類也是高膽固醇食物。當(dāng)從食物中攝入的膽固醇量不足時,肝臟就會啟動自主合成生產(chǎn)線,以補(bǔ)足空缺;反之當(dāng)食物中攝入的膽固醇量充足,肝臟就會降低自主合成產(chǎn)量,以維持供需平衡。在肝細(xì)胞中,這條生產(chǎn)線的“開“與“關(guān)”受肝細(xì)胞內(nèi)部的膽固醇感應(yīng)器調(diào)節(jié)。當(dāng)肝細(xì)胞內(nèi)部的膽固醇量降低到一定水平,這條生產(chǎn)線就會啟動;相反,如果從食品中攝入的膽固醇量已經(jīng)足夠,肝細(xì)胞中的感應(yīng)器會覺查到,相應(yīng)的就會將自主合成生產(chǎn)線關(guān)閉掉。肝臟以乙酰輔酶A(acetyl-CoA)為底物合成膽固醇,乙酰輔酶A的最佳來源是通過氧化分解脂肪酸,這就是為什么吃太多高脂肪食品會造成膽固醇升高的原因。
肝臟就像身體中的后勤部,負(fù)責(zé)采買或自主生產(chǎn)身體中所需的膽固醇和其他營養(yǎng)物質(zhì),然后把這些營養(yǎng)物質(zhì)搭配包裝成脂蛋白微粒輸出到血液循環(huán)中。這些裝載著營養(yǎng)物質(zhì)的脂蛋白微粒,可以比喻為營養(yǎng)包裹,隨血液循環(huán)到達(dá)身體各目標(biāo)器官,各器官按需截取營養(yǎng)包裹,那些沒有被截取的包裹又隨血液循環(huán)回到肝臟。肝臟然后根據(jù)回收到的包裹的數(shù)量和里面所裝的內(nèi)容的反饋調(diào)整下次輸出包裹的數(shù)量和內(nèi)容,以維持對身體的供需平衡。膽固醇供應(yīng)鏈的工作方式有點(diǎn)像轉(zhuǎn)盤壽司餐廳,廚房把一盤盤整理好的食物放到傳送帶上輸出到餐廳里,食客根據(jù)自己的胃口從傳送帶上選取裝有不同食品的盤子,沒有被食客取走的盤子隨傳送帶再回到廚房。廚房根據(jù)回來的盤子里所剩食品的反饋,就知道什么供應(yīng)得太多了什么供應(yīng)不足,從而調(diào)整下一批出盤的內(nèi)容。肝臟就像這個比喻里的廚房,身體各器官就像餐廳里的食客各取所需,脂蛋白微粒就如裝載著不同食品的盤子,而血液循環(huán)就像運(yùn)送盤子的傳送帶。事實(shí)上在肝臟,膽固醇,脂溶性維生素,磷脂和甘油三醇等油脂類營養(yǎng)物質(zhì)會打包在一起形成極低密度脂蛋白微粒(VLDL),然后分泌進(jìn)入血液中。VLDL隨血液循環(huán)去到外周各組織器官,其所運(yùn)載的甘油三脂和磷脂首先被肌肉和脂肪細(xì)胞收割,隨著甘油三酯被不斷收割,VLDL微粒縮小成為IDL,最終失去大部份甘油三脂后變成主要含膽固醇的低密度脂蛋白微粒(LDL)。LDL微粒上的膽固醇稱為低密度膽固醇,即LDL-C。LDL-C就是我們常說的“壞”膽固醇,同時也是肝臟向目標(biāo)組織供運(yùn)膽固醇的主要形式。
身體中所有需要膽固醇的細(xì)胞都會表達(dá)LDL受體,通過受體將載有膽固醇的LDL微粒轉(zhuǎn)運(yùn)進(jìn)入細(xì)胞,從而獲取膽固醇。LDLR是最重要的一種LDL受體,另外還有近10種類似的受體,稱為LRP家族基因。LDLR表達(dá)量最高的細(xì)胞分別是雄性的睪丸,雌性的卵巢,腎上腺和肝細(xì)胞。性腺和腎上腺細(xì)胞很少自己生產(chǎn)膽固醇,主要依賴它們細(xì)胞膜上的LDLR受體截獲血液循環(huán)中被LDL微粒運(yùn)載的膽固醇,并用這些膽固醇作為底物合成性激素和腎上腺皮質(zhì)激素。與其他組織不一樣,肝細(xì)胞膜上的LDLR主要負(fù)責(zé)回收沒有被外周組織截走的多余LDL微粒。這些被肝臟回收的LDL-C要么被再加工包裝成VLDL再次進(jìn)入血液循環(huán),要么被肝臟轉(zhuǎn)化成膽酸后通過分泌膽汁的形式進(jìn)入腸道最終從糞便排出。
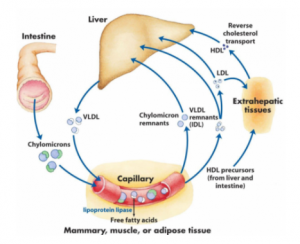
圖4. 膽固醇供應(yīng)鏈上的各組織器官
從膽固醇的供運(yùn)鏈可以看到,肝臟是膽固醇的供應(yīng)協(xié)調(diào)中心。身體中的膽固醇部分來自食品,部份由肝臟自主合成,因?yàn)閺氖称分袛z入膽固醇后實(shí)際上會抑制肝臟合成,最終結(jié)果對血液中的膽固醇濃度影響很小,相反攝入大量高脂肪食品特別是高飽和脂肪酸食品確實(shí)會使血液中LDL-C增高20-30%,原因是燃燒脂肪酸產(chǎn)生的乙酰輔酶A可以被肝臟直接用來合成膽固醇。如果膽固醇濃度極度升高,原因一般不是因?yàn)槌愿吣懝檀际称罚喟胧且驗(yàn)楦闻K回收膽固醇的環(huán)節(jié)出了問題,最常見的是有基因突變發(fā)生在家族性高膽固醇血癥相關(guān)基因上,包括LDLR,APOB,PCSK9基因等。這些基因突變會導(dǎo)致血液循環(huán)中過剩的膽固醇不能被肝臟回收,結(jié)果肝細(xì)胞內(nèi)的膽固醇感應(yīng)器沒有收到來自血液的反饋,以為血液中膽固醇不足,因此不但沒有關(guān)閉肝臟中膽固醇自主合成生產(chǎn)線,反而加大產(chǎn)量和輸出更多的膽固醇。這里我們可以清晰的看到,心血管疾病發(fā)病的位置是心臟,而真正出問題的地方其實(shí)是肝臟。
膽固醇在血液中的運(yùn)輸方式
膽固醇分子是脂溶性分子,不溶于水,必須與其他油脂分子和脂蛋白結(jié)合在一起形成內(nèi)核疏水外表親水的脂蛋白微粒才能在血液中運(yùn)輸。無論食物來源還是肝臟合成的膽固醇都得依靠脂蛋白微粒運(yùn)載。油脂分子包括甘油三脂,磷脂,膽固醇和脂溶性維生素等都必須被包裹成脂蛋白微粒的形式,才能在血液中運(yùn)輸。血液中的脂蛋白微粒是一些大小不同運(yùn)載的油脂組成也不同的小球,它們隨血液循環(huán)將油脂分子運(yùn)送到有需求的組織器官。在血液循環(huán)中主要有五種脂蛋白微粒負(fù)責(zé)上述油脂分子的運(yùn)輸,按大小排例它們分別是乳糜微粒(chylmicrome), 非常低密度脂蛋白微粒(VLDL), 中密度脂蛋白微粒(IDL),低密度脂蛋白微粒(LDL)和高密度脂蛋白微粒(HDL)。這個次序也反映這些脂蛋白微粒的密度從低到高。所有五種脂蛋白微粒都含有甘油三酯,磷脂,膽固醇和脂蛋白,只是每一種油脂的比例不同,其中乳糜微粒來自腸道,核心脂蛋白是apoB48,主要的油脂成份是甘油三酯;VLDL, IDL和LDL都來自肝臟,核心脂蛋白是apoB100,油脂成份VLDL甘油三酯最多,LDL膽固醇最多,IDL在這兩者中間;HDL的核心脂蛋白是apoA,由肝臟合成,然后apoA通過收集外周組織中的膽固醇形成HDL微粒,主要油脂成份是膽固醇。
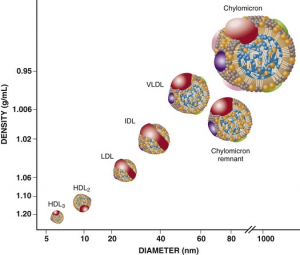
圖5. 血液中的五種脂蛋白微粒
乳糜微粒
乳糜微粒是個頭最大密度最低的脂蛋白微粒。乳糜微粒由腸細(xì)胞制造分泌并經(jīng)淋巴管進(jìn)入血液,其核心脂蛋白是apoB48,負(fù)責(zé)運(yùn)載從食物中吸收的脂質(zhì)類營養(yǎng)包括甘油三脂(85-92%),磷脂(6-12%),膽固醇(1-2%)和脂溶性維生素等。血液中乳糜微粒的量用餐后達(dá)到最高,很快微粒上的大量甘油三酯會被那些可以用脂肪為燃料和可以貯存脂肪的組織迅速”收割”走,這些組織包括心肌,骨胳肌,肝臟和脂肪組織。當(dāng)乳糜微粒上的甘油三脂被“收割”走后,膽固醇仍留在的乳糜微粒殘?bào)w上,殘?bào)w個頭較小,但是比LDL微粒大一些,所以有可能沉積到血管壁上。正常情況下殘?bào)w上的apoE脂蛋白與肝細(xì)胞上的LDLR受體結(jié)合將殘?bào)w內(nèi)吞進(jìn)入肝細(xì)胞,在這里apoE就像一把鑰匙,負(fù)責(zé)打開LDLR這扇通往肝細(xì)胞的門。如果編碼apoE脂蛋白的APOE基因有變異,造成開門的鑰匙有缺陷,結(jié)果會造成乳糜微粒殘?bào)w不能被肝臟及時吸收而滯留在血液中。攜帶某些APOE基因變異的人如果吃了高膽固醇食物,食物來源的膽固醇會濃縮在乳糜微粒殘?bào)w上,如果不能被肝臟及時清除,滯留在血液中會參與動脈粥樣硬化形成。所以這些人需要特別注意飲食中的膽固醇量。一小部分?jǐn)y帶APOE基因變異的人會出現(xiàn)三型高血脂癥,除了基因變異外三型高血脂癥發(fā)病通常與肥胖和飲食中碳水化合物過高有關(guān),臨床表現(xiàn)為甘油三酯嚴(yán)重升高,總膽固醇升高,但是低密度膽固醇LDL-C正常或微弱升高。這些病人如果沒有采取藥物和飲食治療,發(fā)生心血管疾病風(fēng)險會比正常人高出5-10倍。飲食治療對三型高血脂癥非常有效。
極低中度和低密度脂蛋白微粒VLDL,IDL 和LDL
VLDL,IDL 和LDL都起源于肝臟,可以把這三種脂蛋白微粒看成肝臟向外周組織運(yùn)送油脂類營養(yǎng)物的包裹。起源于肝臟的脂蛋白微短核心脂蛋白都是apoB100。VLDL首先由肝臟合成并分泌進(jìn)入血液,在血液循環(huán)中逐漸失去甘油三酯后變成IDL,再從IDL變成LDL。我們前面講過肝臟是身體的后勤部,負(fù)責(zé)釆購合成貯存人體所需的各種營養(yǎng)物質(zhì),然后根據(jù)身體的需求,將營養(yǎng)物質(zhì)分類打包后釋放到血液循環(huán)中。油脂類營養(yǎng)物質(zhì)包括甘油三酯,磷脂,膽固醇和脂溶性維生素等首先在肝臟打包成極低密度脂蛋白微粒VLDL,剛釋放到血液中的VLDL個頭比較大比較輕,含有很大量的甘油三酯;隨著VLDL微粒上的甘油三酯被肌肉和脂肪細(xì)胞 “收割“走后,個頭逐漸變小,成為中等密度的脂蛋白微粒IDL(也被稱為VLDL殘?bào)w);IDL上的甘油三脂被進(jìn)一步“收割“走后,最后成為個頭很小主要含有膽固醇的低密度脂蛋白微粒LDL。每一個LDL微粒含有大約3000個膽固醇分子,LDL微粒上的膽固醇稱為低密度膽固醇,即LDL-C。因?yàn)長DL微粒個頭小膽固醇含量高,最容易進(jìn)入血管壁內(nèi)膜造成動脈粥樣硬化,所以LDL-C被稱為“壞”膽固醇。
LDL-C都是來源于肝臟。食品中攝入的膽固醇并不能直接變成LDL-C,但是飲食中如果攝入大量脂肪,特別是飽合脂肪酸,會促使肝臟自主合成更多膽固醇,所以高脂肪食品會直接造成LDL-C升高,而高膽固醇食品并不能。然而,會造成LDL-C嚴(yán)重升高的原因主要是肝臟回收血液中的LDL微粒的通道出了問題。LDL的核心脂蛋白是apoB100,apoB100上有一個富含正電荷胺基酸的區(qū)域負(fù)責(zé)與LDLR受體相結(jié)合,就像開門的鑰匙一樣打開LDLR這扇門而讓LDL微粒進(jìn)入細(xì)胞。無論“門” 壞了還是 “鑰匙” 壞了其結(jié)果都是LDL微粒不能進(jìn)入肝細(xì)胞而滯留在血液中,造成血液中LDL-C升高。家族性高膽固醇血癥基因LDLR, APOB和PCSK9都是與肝臟回收血液中LDL微粒有關(guān)。這些基因上的某些突變會造成血液中LDL-C極度增高,攜帶這些突變的人如果沒采用降膽固醇治療,發(fā)生早發(fā)心血管病事件的幾率可以是普通人群的10-20倍。
高密度脂蛋白微粒HDL
HDL是血液中個頭最小密度最高的脂蛋白微粒。HDL主要負(fù)責(zé)身體中膽固醇的反轉(zhuǎn)運(yùn),就是從外周細(xì)胞和組織中回收多余和破損的膽固醇,并運(yùn)回肝臟消毀。與前面四種脂蛋白微粒不同,HDL的核心脂蛋白不是apoB,而是由APOA1基因編碼的apoA。apoA首先由肝細(xì)胞合成并以裸體蛋白的形式分泌到血液中。裸體apoA脂蛋就是初始的HDL,它像 “費(fèi)品回收小車 “,隨血液循環(huán)到身體各器官組織中收集過剩或損壞了的膽固醇,并將這些回收來的膽固醇打包后運(yùn)載回到肝臟,這個過程稱為膽固醇反轉(zhuǎn)運(yùn)。越多的膽固醇被HDL收集并運(yùn)送回到肝臟,沉積在血管壁上的膽固醇就越少,動脈粥樣硬化的進(jìn)程就越慢。因此,由HDL運(yùn)載的膽固醇(HDL-C)被稱為” 好” 膽固醇。其實(shí)并不是HDL上的膽固醇本身更好,只是被HDL收集到的膽固醇量越多,膽固醇反轉(zhuǎn)運(yùn)機(jī)制運(yùn)行越好,血管壁越干凈,對心血管健康越好。
“壞”與“好”膽固醇之分
我們每年體檢都會查血脂,家庭醫(yī)生會告訴你,LDL-C是 “壞”膽固醇,最好保持在130mg/dL以下,如果高于這個水平,醫(yī)生多半會給你開他汀類降膽固醇藥;而HDL-C是“好”膽固醇,最好高于50mg/dL,如果你的HDL-C太低,醫(yī)生會告你要多吃蔬菜多鍛練,鍛煉可以升高好膽固醇。醫(yī)生只是為了方便病人理解,用“好”和“壞”來形容不同脂蛋白微粒上的膽固醇。其實(shí)從血液檢測的角度,并無好壞膽固醇之分,測量的都是一樣的膽固醇分子。事實(shí)上,所謂“壞”膽固醇其實(shí)是由肝臟合成的新鮮膽固醇,分子本身更完好無損;而所謂“好”膽固醇其實(shí)是從外周組織和血管壁上回收到HDL微粒上來的膽固醇,有更多老舊破損的膽固醇分子。
膽固醇供運(yùn)鏈與動脈粥樣硬化
膽固醇是我們身體中不可或缺的營養(yǎng)物質(zhì),所有的細(xì)胞和組織都需要膽固醇。肝臟是膽固醇的釆購和供應(yīng)中心,為了向身體各組織器官供應(yīng)膽固醇,膽固醇和其他油脂類營養(yǎng)物質(zhì)首先在肝臟被打包成脂蛋白微粒并釋放到血液中;脂蛋白微粒是血液中運(yùn)載膽固醇和其他油脂類營養(yǎng)的球型包裹,這些大小內(nèi)容不同的包裹隨血液循環(huán)去到各組織器官,把它們所載的營養(yǎng)物質(zhì)送到目的地,其中LDL脂蛋白微粒主要運(yùn)載膽固醇。在膽固醇供應(yīng)鏈的另一端,所有需要獲取膽固醇的組織都會在細(xì)胞表面表達(dá)LDLR,這些受體通過內(nèi)吞機(jī)制將LDL微粒轉(zhuǎn)運(yùn)進(jìn)入細(xì)胞。多余的沒有被外周組織截取的LDL微粒會隨血液循環(huán)回到肝臟,肝臟細(xì)胞表面LDLR會截取LDL微粒并轉(zhuǎn)運(yùn)進(jìn)入肝臟。被肝臟回收的膽固酸會被再次利用或轉(zhuǎn)化成膽酸后排出體外,被回收的膽固醇會給肝臟反饋,從而調(diào)整肝臟的合成和輸出。如果某些與膽固醇回收相關(guān)的基因發(fā)生突變,例如家族性高膽固醇血癥基因,肝臟不能正常回收膽固醇,血液中膽固醇就會升高,隨之心腦血管病的風(fēng)險也會增大。
膽固醇的主要危害是造成動脈粥樣硬使血管狹窄堵塞。不幸的是只要膽固醇供運(yùn)鏈通過血液循環(huán)搞運(yùn)輸,動脈粥樣硬化就時時刻刻在進(jìn)行中,無人能夠逃脫。膽固醇是怎樣參與動脈粥樣硬化的?
且聽下回分解
從基因的角度解析心血管疾病風(fēng)險
(一)從肝臟到心臟
(二)細(xì)說膽固醇
(三)沒人能逃避的動脈粥樣硬化
(四)遺傳組合
(五)精準(zhǔn)醫(yī)學(xué)與營養(yǎng)學(xué)
參考文獻(xiàn):
1. https://en.wikipedia.org/wiki/Cholesterol
2. https://en.wikipedia.org/wiki/Low-density_lipoprotein
3. https://en.wikipedia.org/wiki/De_novo_synthesis
4. Gidding SS, Allen NB. Cholesterol and Atherosclerotic Cardiovascular Disease: A Lifelong Problem. J Am Heart Assoc. 2019 Jun 4;8(11):e012924. PMID: 31137996.
5. Zampelas A , Magriplis E. New Insights into Cholesterol Functions: A Friend or an Enemy? Nutrients. 2019 Jul 18;11(7):1645. PMID: 31323871.
6. Zhang J and Liu Q. Cholesterol metabolism and homeostasis in the brain. Protein Cell. 2015 Apr; 6(4): 254–264. PMID: 25682154.
7. Laws SM et al. Expanding the association between the APOE gene and the risk of Alzheimer's disease: possible roles for APOE promoter polymorphisms and alterations in APOE transcription. J Neurochem. 2003 Mar;84(6):1215-36. PMID: 12614323.
8. Hu J, Zhang Z, Shen WJ, Azhar S. Cellular cholesterol delivery, intracellular processing and utilization for biosynthesis of steroid hormones. Nutr Metab (Lond). 2010 Jun 1;7:47. PMID: 20515451.
9. David E. Cohen. Balancing Cholesterol Synthesis and Absorption in the Gastrointestinal Tract. J Clin Lipidol. 2008 Apr; 2(2): S1–S3. PMID: 19343078.
10. Jones PJ, Pappu AS, Hatcher L, Li ZC, Illingworth DR, W E Connor WE. Dietary Cholesterol Feeding Suppresses Human Cholesterol Synthesis Measured by Deuterium Incorporation and Urinary Mevalonic Acid Levels. Arterioscler Thromb Vasc Biol. 1996 Oct;16(10):1222-8. PMID: 8857917.
11. Hu, F.B., et al., Dietary fat intake and the risk of coronary heart disease in women. N Engl J Med, 1997. 337(21): p. 1491-9. PMID: 9366580.
12. Hu, F.B., J.E. Manson, and W.C. Willett, Types of dietary fat and risk of coronary heart disease: a critical review. J Am Coll Nutr, 2001. 20(1): p. 5-19. PMID: 11293467.
13. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J. 2013 Dec;34(45):3478-90a.
14. Freiberg JJ, Tybjaerg-Hansen A, Jensen JS, et al. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA. 2008 Nov 12;300(18):2142-52. PMID: 19001625.
15. Torvik K, Narverud I, Ottestad I, Svilaas A et al. Dietary counseling is associated with an improved lipid profile in children with familial hypercholesterolemia. Atherosclerosis. 2016 Jul 22;252:21-27. PMID: 27494447.
★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。


















 微信號:美中藥源
微信號:美中藥源