從基因的角度解析心血管疾病風(fēng)險(xiǎn)(三)沒人能逃避的動(dòng)脈粥樣硬化
By 沈驪 GB HealthWatch

第三章:沒人能逃避的動(dòng)脈粥樣硬化
我們總覺得動(dòng)脈粥樣硬化是老年人的毛病,與自己無關(guān),其實(shí)這一過程從孩童時(shí)期就開始了。對(duì)那些攜帶有家族性高膽固醇血癥基因突變的人,膽固醇濃度從小就會(huì)很高,由于血管壁長(zhǎng)期暴露在高膽固醇環(huán)境,這些人在二三十歲的年齡就可以有明顯的動(dòng)脈粥樣硬化,四五十歲時(shí)發(fā)生心肌梗塞事件的幾率會(huì)非常高。表面上看,血液中膽固醇濃度越高,出現(xiàn)動(dòng)脈粥樣硬化的時(shí)間越早,似乎高膽固醇就是問題的源頭。然而大家是否注意到,其實(shí)動(dòng)脈血管和靜脈血管都暴露在相同濃度的膽固醇下,就連抽血檢測(cè)膽固醇抽的也是靜脈血。為什么我們沒聽說過靜脈粥樣硬化呢?事實(shí)上,如果將一段靜脈血管移植到動(dòng)脈血管的位置,比如心臟搭橋手術(shù)中將身體中一段靜脈血管移植到冠狀動(dòng)脈位置,這一段移植來的靜脈血管經(jīng)一段時(shí)間后也會(huì)出現(xiàn)粥樣硬化斑塊。可見光光是膽固醇并不足以造成動(dòng)脈粥樣硬化,那么動(dòng)脈粥樣硬化的起始原因是什么呢?
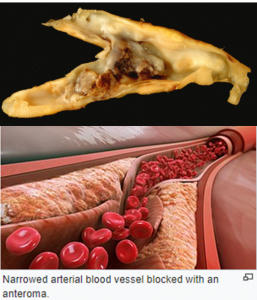
圖 1. 嚴(yán)重粥樣硬化的動(dòng)脈血管剖面圖 。膽固醇和油脂沉積在動(dòng)脈血管內(nèi)皮細(xì)胞與平滑肌之間的夾層中。
動(dòng)脈粥樣硬化的形成過程
科學(xué)界并不完全知道動(dòng)脈粥樣硬化的起因和病理過程。一個(gè)被廣泛接受的假說把動(dòng)脈粥樣硬化的過程描述成四步:第一步,動(dòng)脈血管壁內(nèi)膜的單層內(nèi)皮細(xì)胞層發(fā)生了物理損傷,這是起始點(diǎn)。第二步,富含膽固醇的脂蛋白微粒從損傷處浸潤(rùn)進(jìn)入血管壁內(nèi)皮細(xì)胞層與平滑肌層之間的夾層,膽固醇滯留在夾層中,形成顯微鏡下可觀察到的脂肪紋。第三步,沉積在夾層中的膽固醇被自由基氧化,觸發(fā)免疫細(xì)胞前來清掃;免疫巨噬細(xì)胞由于吞咽了大量膽固醇,在顯微鏡下看起來像泡沫一樣,因此稱為泡沫樣細(xì)胞;隨著巨噬細(xì)胞死亡,其中的膽固醇和油脂泄漏出來聚合在一起,成為動(dòng)脈粥樣硬化中的 “粥” 的部分。第四步,血管壁中層的平滑肌細(xì)胞受到生物信號(hào)刺激向上遷移增生,把油脂和泡沫樣細(xì)胞復(fù)蓋在下面,這些平滑肌細(xì)胞又進(jìn)一步纖維化和鈣化,結(jié)果在 “粥”的上面形成一層磷酸鈣的硬殼; 磷酸鈣就是骨頭的成分所以很硬,因此這種發(fā)生在動(dòng)脈血管壁上的病變叫做動(dòng)脈粥樣硬化。
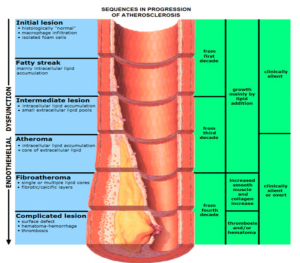
圖2. 動(dòng)脈粥樣硬化的進(jìn)程圖。
在生命的前二十年,膽固醇和油脂就開始在血管壁夾層中逐漸積聚,這個(gè)階段只有在顯微鏡下可以看到有脂肪紋,沒有臨床癥狀,自己不會(huì)有感覺,醫(yī)生也無法診斷。從三十歲開始,一小部份人的血管開始出現(xiàn)稍微的狹窄,也沒有癥狀。從四十歲以后,血管壁夾層中的堆聚物會(huì)變得越來越明顯,相當(dāng)一部分人的血管開始出現(xiàn)狹窄,極少一小部分人可能已經(jīng)嚴(yán)重狹窄。超過五十歲以后,隨著年齡的增長(zhǎng),越來越多的人的血管出現(xiàn)有狹窄區(qū),也就有越來越多的人發(fā)生缺血性心腦血管病事件。這里我們可以看到,動(dòng)脈粥樣硬化是一個(gè)日積月累的過程,在一部份人身上這個(gè)過程發(fā)展的快些而另一部份人慢些。那些因素會(huì)加快動(dòng)脈粥樣硬化的進(jìn)程呢?
血壓的影響
為什么動(dòng)脈粥樣硬化只出現(xiàn)在動(dòng)脈不出現(xiàn)在靜脈?動(dòng)脈血管中血壓高是一個(gè)重要原因。動(dòng)脈血管由三層結(jié)構(gòu)組成,外壁由彈性纖維細(xì)胞組成,中間是平滑肌層,內(nèi)層是由單層上皮細(xì)胞組成的內(nèi)膜。粥樣硬化通常只出現(xiàn)在彈性動(dòng)脈和肌肉動(dòng)脈上,而不會(huì)出現(xiàn)在小動(dòng)脈上。主動(dòng)脈,冠狀動(dòng)脈,頸動(dòng)脈和股動(dòng)脈是最早出現(xiàn)粥樣硬化的部位。彈性動(dòng)脈和肌肉動(dòng)脈的共同特征是都有很厚的中間層平滑肌,用于控制血管的收縮和舒張從而改變血壓。血壓對(duì)血液循環(huán)很重要,沒有血壓血液就不能流動(dòng),就無法把含氧和營(yíng)養(yǎng)物的血液擠壓進(jìn)入需要供氧的器官和組織,比如心肌和大腦等。靜脈血管沒有平滑肌中間層,不能收縮;當(dāng)血液量增加時(shí)靜脈血管壁會(huì)自動(dòng)擴(kuò)張變粗但不會(huì)增加血壓。動(dòng)脈血管壁的內(nèi)膜所受到的血液壓力幾乎是靜脈血管壁的10倍。動(dòng)脈血管必須時(shí)時(shí)刻刻維持一定的壓力來保障血液循環(huán)。血壓升高可能加大對(duì)血管壁內(nèi)膜的損傷。確實(shí)那些參與血管壁平滑肌舒張和控制血壓的基因比如NOS3, GUCY1A1等,這些基因上的某些變異會(huì)顯著增加心血管病風(fēng)險(xiǎn)。
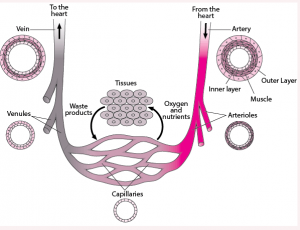
圖3. 動(dòng)脈和靜脈血管的結(jié)構(gòu)
血流動(dòng)力學(xué)的影響
動(dòng)脈血管中除了血壓高以外,受血液流動(dòng)沖擊最大的位置也最容易出現(xiàn)粥樣硬化斑塊位置。觀察基因改造后患上高膽固醇血癥的動(dòng)物模型發(fā)現(xiàn),粥樣硬化斑塊并不是隨機(jī)出現(xiàn)在動(dòng)脈血管的任何區(qū)域,而是有非常固定的位置,總是在動(dòng)脈血管急轉(zhuǎn)彎處或分岔處,并且總是在弧形突出來的一側(cè)。這些位置共同的血流動(dòng)力學(xué)特征是層流減少剪應(yīng)力低(low sheer stress),同時(shí)振蕩流和湍流增加壁面拉應(yīng)力大(high mural tensile stress)。相反在比較直的血管區(qū)段,血流主要是層流,剪應(yīng)力高,血管壁內(nèi)皮細(xì)胞順著血流方向整齊緊密排列,血流中的脂蛋白微粒很難粘附到血管壁上,所以很難發(fā)生粥樣硬化。而在血管轉(zhuǎn)彎和分岔處,血管壁內(nèi)皮細(xì)胞層受到來自湍流的不同方向的沖擊和拉扯,受力不均而且壁面拉應(yīng)力因此對(duì)血管壁的損傷較大。一旦有破損出現(xiàn),血流中的脂蛋微粒就可能粘附到破損處并穿過內(nèi)皮細(xì)胞層進(jìn)入血管壁夾層。同時(shí)這樣的流體動(dòng)力學(xué)特征也會(huì)造成LDL微粒這樣大小密度的顆粒更容易聚集在有湍流的區(qū)域,增加隨機(jī)碰撞到血管壁損傷處的幾率。因?yàn)檠毫鲃?dòng)分分秒秒都在進(jìn)行中,易受損位置分分秒秒受著血流沖擊,日積月累就會(huì)首先出現(xiàn)粥樣硬化病變。
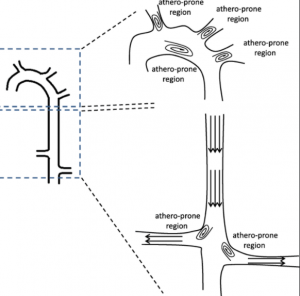
圖4. 血液流動(dòng)的力學(xué)特征決定了動(dòng)脈粥樣硬化出現(xiàn)的位置.
除了血壓和血流強(qiáng)度會(huì)對(duì)血管壁內(nèi)膜造成損傷外,吸煙和高血糖也會(huì)增加血管壁內(nèi)膜的易損性。吸煙會(huì)增加血液中氧化自由基的濃度,可以直接損傷血管壁內(nèi)膜細(xì)胞。
高膽固醇的影響
有了動(dòng)脈血管壁損傷在先,血液中的膽固醇高低就很大程度決定了動(dòng)脈粥樣硬化的快慢。我們可以把血液中的脂蛋白微粒想像成運(yùn)載著油脂和膽固醇的小球。 在第二章中我們講過血液中的脂蛋白微粒分成五種,其中低密度脂蛋白微粒LDL是載有膽固醇最多的一種,每一個(gè)LDL微粒運(yùn)載大約3000個(gè)膽固醇分子。由于血管轉(zhuǎn)彎和分岔處的動(dòng)力學(xué)特征,個(gè)頭較小密度較高的LDL微粒可能更多滯留在轉(zhuǎn)彎處的湍流里,相對(duì)于其他個(gè)頭更大的脂蛋白微粒,LDL粘附到血管壁的破損處的幾率會(huì)更高。血液中大部分膽固醇存在于LDL微粒上,體檢報(bào)告上的低密度膽固醇LDL-C指的就是被LDL微粒運(yùn)載著的膽固醇。不難想象LDL-C升高的結(jié)果會(huì)使更多的膽固醇隨機(jī)粘附到血管壁的破損處,如果沒有被及時(shí)清除,最終會(huì)在那些有破損的位置形成粥樣硬化斑塊。另外,比LDL微粒大一點(diǎn)的殘?bào)w微粒,包括IDL和乳糜微粒殘?bào)w,所含膽固醇量也很高,也相對(duì)容易滯留在血管轉(zhuǎn)彎和分岔的位置,只是通常情況下殘?bào)w微粒會(huì)很快被肝臟清除,只有幾分鐘的半衰期,一般不是動(dòng)脈粥樣硬化的主要原因。但是如果有APOE基因的某些變異,殘?bào)w不能被肝臟快速清除,由殘?bào)w運(yùn)載的膽固醇一樣會(huì)造成動(dòng)脈粥樣硬化。除此以外來自腸道的乳糜蛋白微粒因?yàn)樘貏e大特別輕很難停留在分岔和轉(zhuǎn)彎的位置,與動(dòng)脈粥樣硬化的關(guān)系很小。確實(shí)從基因的角度看,LDLR, APOB,PCSK9基因變異會(huì)降低肝臟回收LDL的能力,造成更多的LDL滯流在血液中,增加粘附到破損的血管壁上的機(jī)會(huì)。同理,如果APOE基因發(fā)生變異造成殘?bào)w微粒不能被肝臟及時(shí)清除,從食品中吸收來的膽固醇就會(huì)較長(zhǎng)時(shí)間滯留在血液中,也會(huì)增加進(jìn)入血管壁夾層的機(jī)會(huì)從而增加動(dòng)脈粥樣硬化的風(fēng)險(xiǎn)。
第二章中我們講過,LDL微粒都起源于肝臟,由LDL微粒運(yùn)載的膽固醇稱為低密度膽固醇LDL-C,就是我們常說的 “壞“膽固醇。“壞”膽固醇并不是這些膽固醇分子本身壞,而是LDL微粒更容易粘附到血管壁損傷處,并因此將LDL-C帶入血管壁夾層,造成動(dòng)脈粥樣硬化。
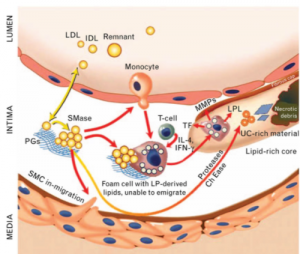
圖5. 動(dòng)脈粥樣化硬化的病理過程示意圖。富含膽固醇的脂蛋白微粒(LDL, IDL and remnant)進(jìn)入到內(nèi)皮細(xì)胞與平滑肌細(xì)胞之間的夾層,被糖蛋白粘附,被自由基氧化,觸發(fā)免疫單核細(xì)胞浸入,泡沫狀細(xì)胞形成,最后血管壁夾層中形成很復(fù)雜的油脂核心。
LDL微粒進(jìn)入血管壁夾層后,少數(shù)還會(huì)跑出來重新回到血液循環(huán)中,而大多數(shù)沒有跑出來的,會(huì)被夾層基質(zhì)中帶負(fù)電荷的蛋白多糖吸附,滯留在夾層中。蛋白多糖對(duì)LDL微粒的吸附多半是通過apoB100上帶正電荷的區(qū)域。每一個(gè)LDL微粒都含有一個(gè)apoB100蛋白質(zhì),apoB100是身體中最大的蛋白質(zhì)分子之一,有四千多個(gè)胺基酸,整個(gè)分子包裹在LDL微粒的表面,其肽鏈的N端有一個(gè)含正電荷的LDL受體結(jié)合區(qū)域,apoB100上這個(gè)區(qū)域就像”鑰匙”一樣,用于與細(xì)胞膜表面的LDLR受體結(jié)合,從而將LDL微粒轉(zhuǎn)運(yùn)進(jìn)入肝臟和其他需要膽固醇的目標(biāo)細(xì)胞。血管壁夾層基質(zhì)含有大量蛋白多糖,在生理?xiàng)l件下這些蛋白多糖帶負(fù)電荷,因此正負(fù)電荷相互吸引,LDL微粒一旦進(jìn)了夾層就很難跑出來。時(shí)間一長(zhǎng),LDL上的膽固醇和油脂以及蛋白質(zhì)都會(huì)被自由基氧化,成為oxLDL。被氧化了的膽固醇會(huì)被免疫系統(tǒng)視為有害物質(zhì),因此免疫細(xì)胞會(huì)前來清除。前來清除oxLDL的免疫細(xì)胞主要是巨噬細(xì)胞,通過吞噬機(jī)制把oxLDL粒吞進(jìn)溶酶體中,在那兒LDL被消化拆分,部份油脂和膽固醇分子會(huì)被送到線粒體中燃燒產(chǎn)生能量,更多的膽固醇分子則會(huì)被酯化后貯存在巨噬細(xì)胞中的油泡里,如果夾層中積有太多的膽固醇和油脂,巨噬細(xì)胞會(huì)因?yàn)椴粩嗤倘肽懝檀己陀椭斐杉?xì)胞中的油泡變得越來越大,巨大的乳白色的油泡在顯微鏡下看起來像泡沫一樣,所以稱為泡沫細(xì)胞。泡沫細(xì)胞的形成是動(dòng)脈粥樣硬化的一個(gè)里程碑。
這里要單獨(dú)講一下Lp(a),它是LDL的脂蛋白微粒的亞型,比普通的LDL多了一條尾巴,血脂查測(cè)時(shí)LDL-C濃度包括了Lp(a)上的膽固醇。每個(gè)Lp(a)是由一個(gè)LDL微粒通過二硫鍵與一條脂蛋白a肽鏈連接在一起。Lp(a)不像普通的LDL會(huì)被肝細(xì)胞上的LDLR受體結(jié)合并轉(zhuǎn)運(yùn)進(jìn)入肝臟被清除,所以降膽固醇他汀類藥不能降Lp(a)這部份膽固醇。更重要的是,Lp(a)的脂蛋白a肽鏈上有一個(gè)賴胺酸結(jié)合位點(diǎn),使它比普通的LDL更容易粘附到血管壁損傷處,因此Lp(a)升高比普通的LDL升高危害更大。Lp(a)與心血管病關(guān)系極大,有很長(zhǎng)的故事要講,作者將在第四章遺傳組合中詳細(xì)介紹。
在清掃膽固醇的路上
血管壁夾層中的膽固醇是怎么被清除的呢?清除組織和細(xì)胞中多余的膽固醇主要依靠膽固醇反轉(zhuǎn)應(yīng)機(jī)制(reverse cholesterol transport )。膽固醇反轉(zhuǎn)運(yùn)比較復(fù)雜,主要由HDL來完成。HDL又稱為高密度脂蛋白,專門負(fù)責(zé)去到身體各組織器官回收過剩或損傷的膽固醇,并將它們運(yùn)回到肝臟加以再利用或消毀。我們可以將HDL想象成回收膽固醇的小車,其車身是apoA脂蛋白。apoA首先由肝臟合成并分泌到血液中,最初始的HDL只是裸體的apoA蛋白質(zhì),就像還沒載貨的空車。HDL隨血液循環(huán)去到外周組織和細(xì)胞間,在那兒HDL會(huì)嵌合到細(xì)胞膜上的分子泵ABCA1上,誘導(dǎo)ABCA1將細(xì)胞內(nèi)的自由膽固醇分子泵出到HDL上。到了HDL上的自由膽固醇分子然后被酯化后包裝成緊密的膽固醇核,這樣每個(gè)HDL微粒可以裝載更多的膽固醇。催化膽固醇酯化的酶稱為卵磷脂膽-膽固醇酰基轉(zhuǎn)移酶(Lecithin Cholesterol Acyltransferase,LCAT),酯化反應(yīng)需要卵磷酯作供體,蛋黃是卵磷酯含量最高的食物,所以吃雞蛋會(huì)使HDL-C增高。在血液循環(huán)中,載有回收來的膽固醇的HDL微粒會(huì)與主要是甘油三酯的VLDL微粒碰頭,這兩個(gè)脂蛋白微粒之間會(huì)進(jìn)行甘油三酯-膽固醇互換,這個(gè)交換過程由CETP基因負(fù)責(zé);如果CETP活性不足,HDL上的膽固醇不能交換去到VLDL上,結(jié)果血液中高密度膽固醇HDL-C會(huì)升高。HDL-C就是我們通常說的“好”膽固醇。然而由于CETP失活而造成的HDL-C升高是否會(huì)有利于健康還不完全清楚,藥物開發(fā)上通過藥物抑制CETP確實(shí)能顯著提高HDL-C,但這樣升高的HDL-C在臨床實(shí)驗(yàn)中并沒有顯示降低心血管病的收益,相反在好幾個(gè)臨床實(shí)驗(yàn)中顯示增大風(fēng)險(xiǎn)。
膽固醇反轉(zhuǎn)運(yùn)的最后一步,是肝臟接收HDL運(yùn)載回來的膽固醇,并把多余和受損的膽固醇轉(zhuǎn)化為膽酸,以膽汁的形式排除肝臟。肝細(xì)胞用于回收HDL-C的受體SCARB1又稱為清道夫受體(scavenger receptor),負(fù)責(zé)膽固醇反轉(zhuǎn)運(yùn)的最后一步。SCARB1負(fù)責(zé)卸載HDL微粒上的膽固醇,卸完貨的空車HDL可以重新回到血液循環(huán)中再次裝貨,如果SCARB1基因發(fā)生變異,卸貨不完全不及時(shí),會(huì)使HDL微粒上膽固醇超載。比較常見的SCARB1 變異會(huì)造成HDL運(yùn)載的膽固醇不能被肝臟有效回收,致使HDL上膽固醇超栽。攜帶這個(gè)SCARB1變異的人,會(huì)有非常高的HDL-C水平,通常在70-150mg/d L。請(qǐng)注意SCARB1變異造成的HDL-C升高不但不是好亊,反而嚴(yán)重增加心血管病風(fēng)險(xiǎn)。這是因?yàn)镾CARB1缺陷雖然表面上看使血液中HDL-C升高,但實(shí)質(zhì)上是卸空HDL出了問題,膽固醇反轉(zhuǎn)運(yùn)通道受阻。有SCARB1缺陷的人血液中HDL微粒會(huì)變得很大,可以比普通人的大出好幾倍,心血管疾病風(fēng)險(xiǎn)也隨之比普通人群高出2-3倍。SCARB1導(dǎo)致的HDL-C升高和心血管疾病風(fēng)險(xiǎn)只有通過基因檢測(cè)才能確定。
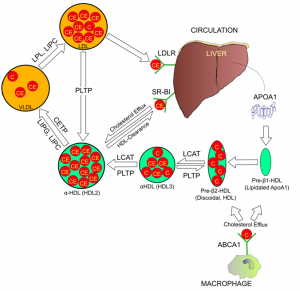
圖6. 膽固醇反轉(zhuǎn)運(yùn)通道上HDL微粒從肝臟出發(fā)再回到肝臟的過程。各個(gè)基因在這條清掃膽固醇路上的作用
另外SCARB1基因除了在肝臟大量表達(dá)外,也在合成甾體激素的組織中有高表達(dá),例如腎上腺,睪丸和輸卵管等組織都表達(dá)大量的SCARB1。這表明由HDL收集來的膽固醇除了去肝臟外,也可被這些組織利用作為原料合成腎上腺皮質(zhì)激素和性激素。
膽固醇反轉(zhuǎn)運(yùn)通道上的基因突變會(huì)影響動(dòng)脈粥樣硬化的進(jìn)程。但這些基因的作用又遠(yuǎn)小于家族性高膽固醇血癥基因。APOA1,ABCA1 和LCAT基因突變都會(huì)造成HDL-C水平極低。ABCA1缺失會(huì)造成稱為丹吉爾病(Tangir’s disease),表現(xiàn)為HDL-C極度低,小于20mg/dL, 心血管病增加,但發(fā)病年齡在60-70歲以上。LCAT基因突變會(huì)導(dǎo)致魚眼病(Fish eye disease),因?yàn)槟懝檀疾荒鼙磺宄e聚在眼睛角膜上讓角膜看起來發(fā)白。CETP基因活性降低會(huì)使HDL-C升高,現(xiàn)在更多的證據(jù)指向如此升高的HDL-C并不降低心血管病風(fēng)險(xiǎn)。SCARB1基因突變會(huì)造成HDL-C顯著升高同時(shí)心血管病風(fēng)險(xiǎn)也升高。所以HDL-C不能簡(jiǎn)單的理解成”好”膽固醇,HDL-C水平低固然不好,說明膽固醇反轉(zhuǎn)運(yùn)不給力,然而也不是HDL-C越高越好,要看是什么原因造成的升高。如果HDL-C特別高,超過70mg/dL就不見得是好亊了,最好能通過基因檢測(cè)排出膽固醇反轉(zhuǎn)運(yùn)通道上的基因突變。
氧化自由基
血液中的過氧化自由基會(huì)直接損傷血管壁內(nèi)皮細(xì)胞因此增加動(dòng)脈粥樣硬化。吸煙是已知的心血管疾病風(fēng)險(xiǎn)因素,吸煙的一個(gè)要害是直接增加血液循環(huán)中的氧化自由基,造成內(nèi)皮細(xì)胞易受損。身體中的氧化自由基通常通過抗氧化劑和抗氧化酶來清除。在血管壁內(nèi)皮細(xì)胞上通過表達(dá)超氧化物歧化酶(superoxide dismutase,SOD)來分解超氧化物,保護(hù)血管壁內(nèi)膜。SOD3是一種存在于血管壁內(nèi)皮細(xì)胞外的抗氧化酶,這個(gè)基因上某些變異會(huì)造成這個(gè)酶從內(nèi)皮細(xì)胞表面脫落,結(jié)果血管壁內(nèi)膜更容易被抗氧化自由基損傷。攜帶某些SOD3基因變異的人群患上心血管病的幾率比沒有這個(gè)突變的人大約要高1.7倍,而那些既有SOD3變異又吸煙的人,心血管病風(fēng)險(xiǎn)會(huì)更高。另外一個(gè)參與清除氧化膽固醇o(jì)x-LDL的基因OLR1,某些變異會(huì)增加大約二倍的獨(dú)立風(fēng)險(xiǎn)。ox-LDL的形成是動(dòng)脈粥樣硬化的重要一環(huán),ox-LDL會(huì)觸發(fā)免疫單核細(xì)胞浸潤(rùn)進(jìn)血管壁夾層,引發(fā)痰癥反應(yīng),加速動(dòng)脈粥樣硬化的進(jìn)程。因?yàn)槟懝檀际侵芊肿樱枰苄钥寡趸瘎﹣肀Wo(hù)。維生素E是身體中最常見的脂溶性抗氧化劑,但是一分子維生素E只能消滅一分子氧化自由基,而氧化自由基是源源不斷的從細(xì)胞中產(chǎn)生,所以實(shí)際情況是身體中強(qiáng)大的抗氧化系統(tǒng)通過維生素C不斷還原再生出有抗氧化活性的維生素E。維生素C負(fù)責(zé)還原維生素E,而維生素C本身可以被谷胱甘肽還原,谷胱甘肽被NADPH還原,而NADPH可以通過戊糖磷酸通路(Pentose phosphate pathway)分解葡萄糖源源不斷的生產(chǎn)。想了解身體如何抗擊氧化自由基的讀者可以參考作者曾經(jīng)寫過的科普”維生素生素C的故事”。
另外如果身體缺乏葉酸,血液中同型半胱胺酸增高,也會(huì)增加內(nèi)皮細(xì)胞損傷;可以造成同型半胱升高的基因突變,例如CBS基因的某些突變也會(huì)顯著增加心血管病風(fēng)險(xiǎn)。多吃綠葉蔬菜或補(bǔ)充葉酸可以非常有效的降低同型半胱氨酸。
沒人能夠逃脫的動(dòng)脈粥樣
通過CT掃描可以檢查和跟蹤病人血管上粥樣硬化斑塊的大小和發(fā)展。這項(xiàng)研究發(fā)現(xiàn),粥樣硬化斑塊區(qū)域的大小與年齡相關(guān)性最強(qiáng),年齡可以解釋大約50%原因,其次是性別,男性比女性的情況壞很多,然后分別是吸煙,舒張壓高,在吃降血脂藥(有高血脂)和在吃降血壓藥 (有高血壓)。跟蹤一年后這些病人的斑塊進(jìn)展情發(fā)現(xiàn),LDL-C高是斑塊繼續(xù)變大變壞的第一大因素,高血壓是第二大因素,高甘油三酯是第三大因素,但比前面兩個(gè)因素的作用小很多,其他因素影響甚微。
我們可以清淅的看到動(dòng)脈粥樣硬化的發(fā)生和發(fā)展是一個(gè)長(zhǎng)期累積的過程,我們出生就開始一點(diǎn)點(diǎn)沉積病變,但要到了中老年后才會(huì)出現(xiàn)癥狀。只要我們活著,只要血液在我們身上流淌,我們就無法逃脫動(dòng)脈粥樣硬化的命運(yùn)。有的人運(yùn)氣好天生有最佳的基因組合,又有良好的飲食健康習(xí)慣,活到100歲動(dòng)脈血管仍然可以比較暢通;而有的人很不幸天生基因組合就不夠好,再加上飲食生活習(xí)慣選擇與基因不對(duì)應(yīng)讓情況更糟,就有可能在正當(dāng)壯年時(shí)發(fā)生心肌梗塞亊件。沒有人能選擇自己的基因組合,都是父母那兒遺傳來的,但是我們可以選擇管理好我們的基因,爭(zhēng)取早診早預(yù)防早治療,利用科學(xué)的手段改變命運(yùn)。
且聽下回分解
從基因的角度解析心血管疾病風(fēng)險(xiǎn)
(一)從肝臟到心臟
(二)細(xì)說膽固醇
(三)沒人能逃避的動(dòng)脈粥樣硬化
(四)遺傳組合
(五)精準(zhǔn)醫(yī)學(xué)與營(yíng)養(yǎng)學(xué)
參考文獻(xiàn):
1. https://en.wikipedia.org/wiki/Atherosclerosis
2. https://en.wikipedia.org/wiki/Cardiovascular_disease
3. https://www.heart.org/en/health-topics/cholesterol/about-cholesterol/atherosclerosis
4. https://www.merckmanuals.com/home/heart-and-blood-vessel-disorders/biology-of-the-heart-and-blood-vessels/biology-of-the-blood-vessels
5. Lee D, Chiu J. Atherosclerosis and flow: roles of epigenetic modulation in vascular endothelium. J Biomed Sci. 2019 Aug 7;26(1):56.
6. Borén J, Kevin Jon Williams KJ. The central role of arterial retention of cholesterol-rich apolipoprotein-B-containing lipoproteins in the pathogenesis of atherosclerosis: a triumph of simplicity. Curr Opin Lipidol. 2016 Oct;27(5):473-83. PMID: 27472409.
7. Tansey EA, Laura E A Montgomery LEA, Quinn JG, Roe SM, Johnson CD. Understanding basic vein physiology and venous blood pressure through simple physical assessments. Adv Physiol Educ. 2019 Sep 1;43(3):423-429.
8. Wobst J, Schunkert H, Kessler T. Genetic alterations in the NO-cGMP pathway and cardiovascular risk. Nitric Oxide. 2018 Jun 1;76:105-112. PMID: 29601927.
9. Kessler T, Wolf B, Niclas Eriksson N, et al. Association of the coronary artery disease risk gene GUCY1A3 with ischaemic events after coronary intervention.
10. Nordestgaard BG and Benn M. Genetic testing for familial hypercholesterolaemia is essential in individuals with high LDL cholesterol: who does it in the world? Eur Heart J. 2017 May 21;38(20):1580-1583. PMID: 28419271
11. Cardiovasc Res. 2019 Aug 1;115(10):1512-1518. PMID: 30768153Bowe B, Xie Y, Xian H, Balasubramanian S, et al. High Density Lipoprotein Cholesterol and the Risk of All-Cause Mortality among U.S. Veterans. Clin J Am Soc Nephrol. 2016 Oct 7;11(10):1784-1793. PMID: 27515591.
12. Madsen CM, Anette Varbo A, Nordestgaard BG. Extreme high high-density lipoprotein cholesterol is paradoxically associated with high mortality in men and women: two prospective cohort studies. Eur Heart J. 2017 Aug 21;38(32):2478-2486. PMID: 28419274.
13. Zanoni P, Sumeet A Khetarpal SA, Daniel B Larach DB et al. Rare variant in scavenger receptor BI raises HDL cholesterol and increases risk of coronary heart disease. Science. 2016 Mar 11;351(6278):1166-71. PMID: 26965621.
14. Tietjen I, Hovingh GK, Singaraja R, et al. Increased risk of coronary artery disease in Caucasians with extremely low HDL cholesterol due to mutations in ABCA1, APOA1, and LCAT. Biochim Biophys Acta. 2012 Mar;1821(3):416-24. PMID: 21875686.
15. Frikke-Schmidt R, Nordestgaard BG, Stene MC, et al. Association of loss-of-function mutations in the ABCA1 gene with high-density lipoprotein cholesterol levels and risk of ischemic heart disease. JAMA. 2008 Jun 4;299(21):2524-32.
16. Tatsuguchi M,Furutani M, Jun-ichi Hinagata J,et al. Oxidized LDL receptor gene (OLR1) is associated with the risk of myocardial infarction. Biochem Biophys Res Commun. 2003 Mar 28;303(1):247-50. PMID: 12646194.
17. J. David Spence. Genetics of atherosclerosis: the power of plaque burden and progression: invited commentary on Dong C, Beecham A, Wang L, Blanton SH, Rundek T, Sacco RL. Follow-Up association study of linkage regions reveals multiple candidate genes for carotid plaque in Dominicans atherosclerosis 223 (1) (2012) 177-183.. 2012 Jul;223(1):98-101. PMID: 22648086.
★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源