
干貨!抗體偶聯(lián)藥物(ADC)深度研究報告 | 【凱泰資本原創(chuàng)分享】
作者:周正
前言
凱泰資本生物技術(shù)團隊組建于2011年,專注于生物制藥與精準(zhǔn)醫(yī)療方面的早期投資,致力于發(fā)掘生物技術(shù)領(lǐng)域的產(chǎn)業(yè)化機會。目前主要關(guān)注生物大分子藥物、化學(xué)小分子藥物、跨膜多肽藥物以及基因治療、細(xì)胞治療等領(lǐng)域具有創(chuàng)新力的研發(fā)型公司,致力于幫助創(chuàng)業(yè)團隊實現(xiàn)產(chǎn)業(yè)化,用資本的力量推動醫(yī)療健康產(chǎn)業(yè)的發(fā)展,造福全球患者。凱泰資本作為研究型投資機構(gòu),對抗體偶聯(lián)藥物的行業(yè)與技術(shù)方面進行了分析介紹,并對ADC成功要素進行了分析:1、獨家技術(shù);2、優(yōu)秀的研發(fā)團隊;3、優(yōu)選研發(fā)方向。歡迎各位投資界同行與生物制藥從業(yè)人員交流指正。
目錄
一、行業(yè)背景
- 針對病癥
- 歷史沿革
- 基本原理介紹
二、核心技術(shù)
- 抗體部分(1)靶點選擇(2)抗體選擇(3)抗體修飾(4)抗體內(nèi)吞
- 連接物部分(1)?連接物(Linker)選擇(2)?連接方式及DAR(3)?新技術(shù)Abzena的ThioBridge
- 毒素部分
- 核心專利-連接物與毒素排序
三、效果對比:Kadcyla對比Herceptin
四、核心公司競爭情況
1. 領(lǐng)先公司
(1)Seattle Genetics
(2) ImmunoGen
(3) Immunomedics
2. 規(guī)模較大公司
(1)?Abzena
(2)?Agensys
(3)?Celldex
(4)?Progenics Pharmaceuticals
(5)?Genmab
(6)?Sorrento旗下Concortis
3. 大型藥企在ADC領(lǐng)域的布局
(1)?Abbvie及其旗下Stemcentrx
(2)?Roche旗下Genetech的情況
(3)?武田旗下Takeda?Oncology
(4)?輝瑞ADC產(chǎn)品Mylotarg
(5)?復(fù)星、藥明、浙江醫(yī)藥與Ambrx
(6)?三生制藥及三生國健
(7)?麗珠醫(yī)藥集團旗下麗珠單抗
(8)?江蘇恒瑞醫(yī)藥
(9)?四川恒康旗下上海美雅珂生物
(10)?其他藥企
五、?行業(yè)市場規(guī)模
六、?ADC成功要素分析
- 獨家技術(shù)
- 優(yōu)秀團隊
- 研發(fā)方向
一、?行業(yè)背景
抗體偶聯(lián)藥物Antibody-drug Conjugate (ADC)?是擁有強細(xì)胞毒性的化療藥物通過連接物與單抗偶聯(lián)形成的,兼具小分子藥物強大的殺傷力和純單抗高度的靶向性,因而成為腫瘤靶向治療的研究和發(fā)展熱點。但是,ADC本身并非在各方面強于純單抗。其療效的顯著提升是通過犧牲藥品的均一性與穩(wěn)定性實現(xiàn)的。現(xiàn)在比較成熟的兩種偶聯(lián)技術(shù)分別側(cè)重均一性與穩(wěn)定性,有一些新式偶聯(lián)技術(shù)能夠在兩方面同時改善。
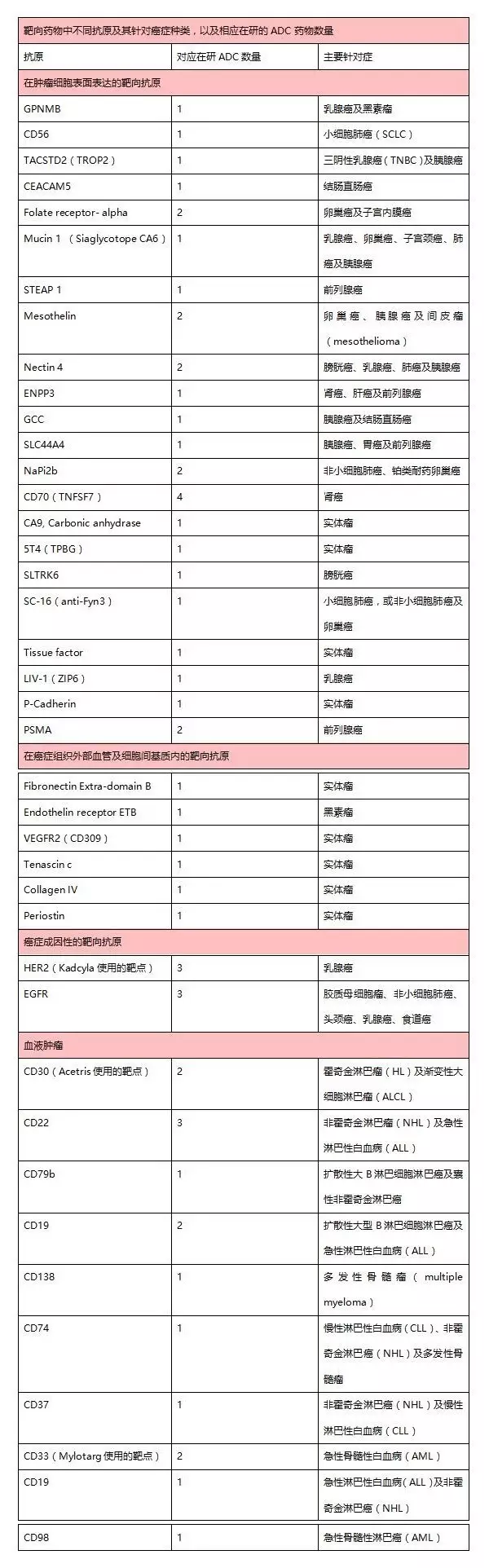
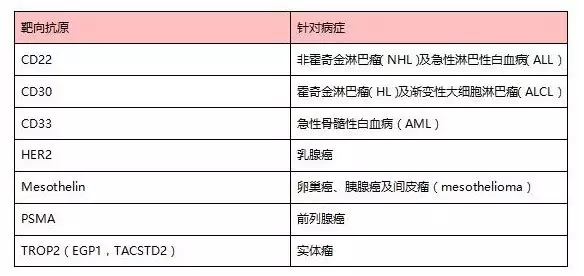
1、?針對病癥
表:目前上市及臨床ADC藥物使用的靶點統(tǒng)計
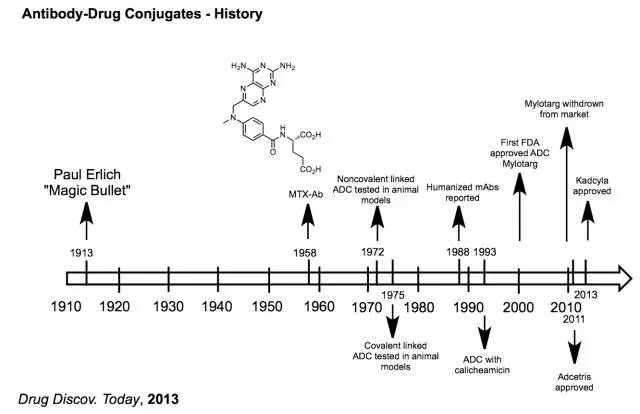
2、?歷史沿革
ADC的概念最早始于德國醫(yī)學(xué)家、諾貝爾獎得主Paul Erlich在1913年的Magic Bullet設(shè)想(指選擇對付致病機體的化合物,始于對梅毒治療方法的設(shè)想)。最早獲FDA審批的ADC藥物為輝瑞的Mylotarg,于2000年上市用于治療急性髓細(xì)胞樣白血病acute myeloid leukemia?(AML),于2010年6月由于臨床試驗顯示該藥反而增加了死亡率(5.7%相對對比組的1.4%)而撤市。2017年7月,美國食品和藥物管理局(FDA)腫瘤藥物顧問委員會(ODAC)以6票贊成1票反對的結(jié)果認(rèn)為來自III期臨床研究ALFA-0701的數(shù)據(jù)證明了Mylotarg聯(lián)合化療用于治療新診CD33陽性急性髓性白血病(AML)具有有利的風(fēng)險收益比。FDA顧問委員會的作用是向FDA提供關(guān)于藥品審查方面的建議。FDA預(yù)計將在2017年9月作出是否批準(zhǔn)Mylotarg的決定。由此可見,Mylotarg有很大可能重新被用于治療AML。目前在市的ADC藥物為2011年上市的武田和Seattle Genetics的Adcetris(CD30抗原)和2013年上市的羅氏旗下Genentech的kadcyla(HER2抗原)。
表:ADC發(fā)展歷程
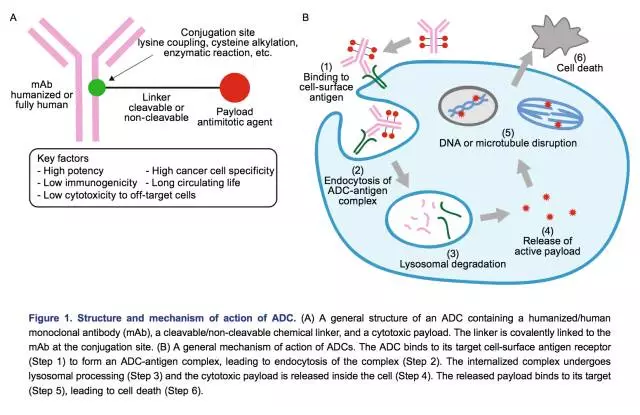
3、?基本原理介紹
ADC的靶向性來自其中抗體部分(antibody),毒性大部分來自小分子化藥毒物部分(payload),抗體部分也可以帶有毒性(ADCC與CDC)。抗體部分與化藥部分通過連接物(linker)互相連接。抗體部分與腫瘤細(xì)胞表面的靶向抗原結(jié)合(binding)后,腫瘤細(xì)胞會將ADC內(nèi)吞(endocytosis)。之后ADC藥物會在溶酶體中分解(lysosomal degradation),釋放出活性的化藥毒物,破壞DNA或阻止腫瘤細(xì)胞分裂,起到殺死細(xì)胞的作用。理想化的連接物應(yīng)該保持穩(wěn)定所以不會導(dǎo)致靶外毒性(off-target toxicity),并且在細(xì)胞內(nèi)高效釋放毒物。
表:ADC藥物的作用機制
二、核心技術(shù)

1、?抗體部分
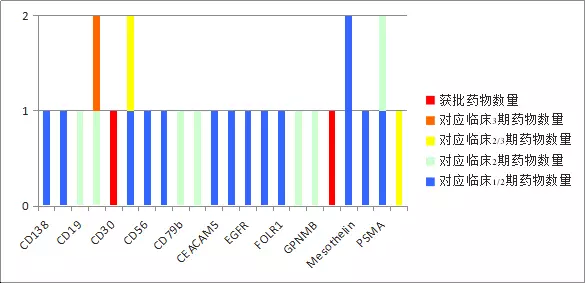
(1)?靶點選擇
ADC選擇的靶點都是與腫瘤相關(guān)的,并且與血液腫瘤相關(guān)的會比較多。其選擇靶點的標(biāo)準(zhǔn)與其他單抗藥類似,要求生物學(xué)機制清晰且存在未滿足醫(yī)療需求。目前各靶點到達臨床階段的ADC藥物請見第一章第1節(jié)。將各種靶點對應(yīng)的臨床2期以后的藥物數(shù)量進行統(tǒng)計,可以得到下圖。
(2)?抗體選擇
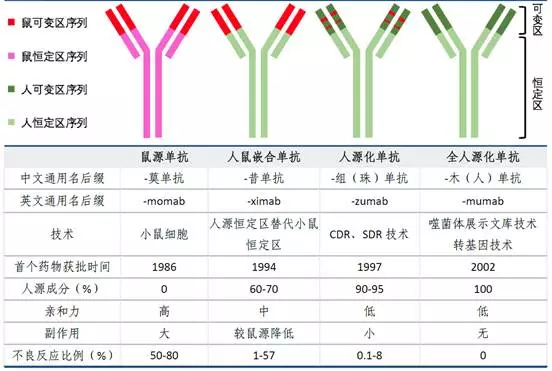
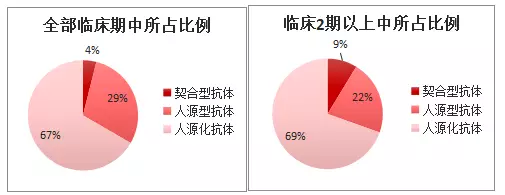
在ADC中,抗體在連接后能夠保持其作為單抗時的特性,包括抗體依賴細(xì)胞毒性(ADCC)、補體依賴毒性(complement-dependent cytotoxicity)等,會導(dǎo)致ADC藥物毒性的增強、腫瘤定位(tumor localization)精確度的減少及ADC的腫瘤細(xì)胞內(nèi)吞效應(yīng)。過去研發(fā)的單抗藥能夠用于ADC的研發(fā),其好處是能夠降低研發(fā)風(fēng)險、ADCC效應(yīng)增強療效(微弱)及適應(yīng)癥人群可能更多(偶聯(lián)后療效顯著更好,能夠作為單抗使用復(fù)發(fā)治療),壞處是面臨專利問題。目前上市的兩款A(yù)DC藥物中,2013年的Kadcyla的使用抗體部分就是在1998年上市的Transtuzumab?(Herceptin),并且Kadcyla目前作為Herceptin的復(fù)發(fā)療法使用。Herceptin與Kadcyla均為Genentech研發(fā)的所以能夠被使用,但目前Herceptin已經(jīng)專利過期。1998年的Transtuzumab同時被目前臨床1期藥物SYD985與上市藥物Kadcyla兩種ADC藥物使用,其他并無已知在研ADC使用現(xiàn)存抗體藥物。這是由于在不知道生產(chǎn)工藝的情況下制造已知序列的抗體成本依舊較高,并且有市場占有的考慮。但是有一些ADC公司在接受單抗授權(quán)后研發(fā)(比如ADC?Therapeutics)。而且,由于ADC必須被內(nèi)吞才能夠發(fā)揮作用,只有針對能夠形成內(nèi)吞效應(yīng)的receptor的抗體才能夠被使用。之后的本章第(4)節(jié)會對內(nèi)吞情況做一些描述。
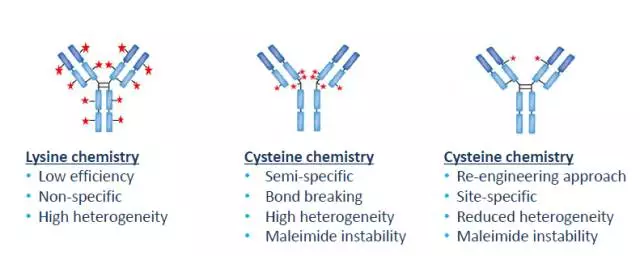
(3)?抗體修飾
對于如Seattle?Genetics之類領(lǐng)先的ADC公司來說,抗體還會被修飾以增強效果。ADC中抗體的修飾技術(shù)分為兩類,其一是修飾可連接的位點,將一般抗體修改成THIOMAB來使ADC產(chǎn)品連接的毒素數(shù)目更加均勻,顯著減少產(chǎn)品中混雜的次品比例。這種方法能夠解決ADC生產(chǎn)中的核心問題。該技術(shù)詳見本章第2部分末尾Cysteine?chemistry。
第二種主要為糖基化修飾,分以下幾類。其中,去巖藻糖基化是十分有效的新技術(shù),被Seattle?Genetics與許多純單抗研發(fā)商使用。
1、 低密度靜置培養(yǎng),提高半乳糖基化,增強CDC;
2、 去巖藻糖基化,增強與Fc-gamma-RIIIa的親和力,增強ADCC;
3、 降低末端唾液酸化,增強ADCC;
4、 提高末端乙酰葡糖胺基化,增強ADCC;
5、 用甘露糖苷酶抑制劑處理CHO細(xì)胞,能提高甘露糖基化,去巖藻糖基化,顯著提高ADCC,略微降低CDC;
(4)?抗體內(nèi)吞
并不是每種靶點都可以內(nèi)吞,而且每種抗體-抗原配對的內(nèi)吞效率都不一樣。部分靶點能夠直接導(dǎo)致對抗體的內(nèi)吞,其他靶點有的可以通過對抗體的選擇造成抗體與靶點之間的互相作用導(dǎo)致內(nèi)吞。
能夠直接造成內(nèi)吞效應(yīng)的受體有以下幾種:
1、?吸收物質(zhì)用,如LDL?receptor吸收LDL、?Transferrin吸收鐵。
2、?從細(xì)胞表面至核傳到信號,這其中傳導(dǎo)信號時需要合成特殊的信號復(fù)體complexe的激素較多。許多生長因子是這一類,如EGF刺激EDFR時。下圖為EGFR被激活后內(nèi)吞并運輸至細(xì)胞核。
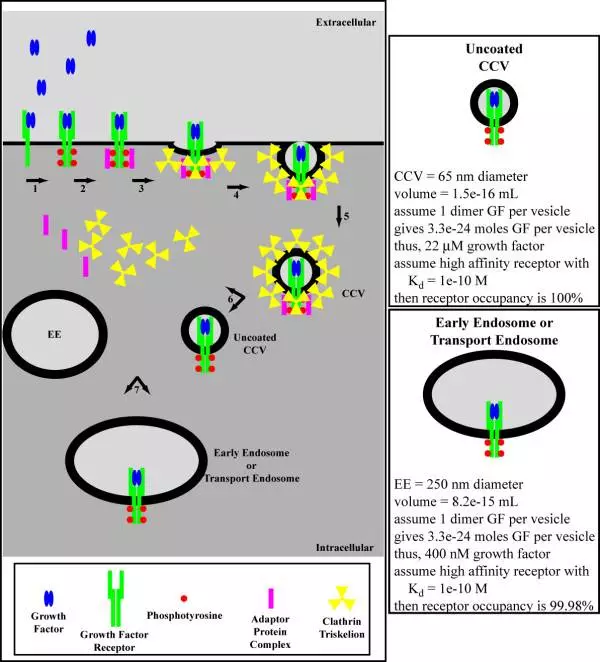
抗體內(nèi)吞時還存在內(nèi)吞效率,是一種針對細(xì)胞外濃度的百分比,決定多少劑量最終能夠產(chǎn)生效果。不僅是內(nèi)吞效率,之后的各個步驟都有效率的問題,這些效率共同決定了藥物的療效(參考本章3節(jié)毒素部分第一張圖)。內(nèi)吞主要由靶點決定,但抗體也有一些影響。如CD20,一般不太內(nèi)吞,但抗體選擇好了也會較好內(nèi)吞。內(nèi)吞效率評價時需要用ADC藥物的IC50體現(xiàn)。大部分靶點有內(nèi)吞現(xiàn)象,但速率不同,而且內(nèi)吞一下就回上來(early sorting)、late endosome還是進入lysosome有區(qū)別。內(nèi)吞由靶點與抗體結(jié)合的comfort change決定。一般使用ADCC效應(yīng)的裸抗藥要求內(nèi)吞越少越好,但ADC要求內(nèi)吞越多越深越好,兩者選擇抗體及靶點的標(biāo)準(zhǔn)不同。篩選有足夠內(nèi)吞性質(zhì)的抗體的方法為使用endosomal trafficking的marker篩進lysosome的,或者使用用high content imagining。后者的問題是通量較低且沒有true cell killing的數(shù)據(jù)。
2、?連接物部分
連接物大致能夠分成Linker與Attachment?site兩部分。Linker的特點為:
-?降解cleavable或者非降解non-cleavable
-?除在特定條件下釋放藥物外,平時性質(zhì)穩(wěn)定
Attachment?site(Linker與antibody的連接點)的特點為:
-?一般通過半胱氨酸殘基cysteine?residue(使用disulfide?interchain?bridge)或者賴氨酸殘基lysine?residue(使用epsilon-amino?group)連接至抗體上
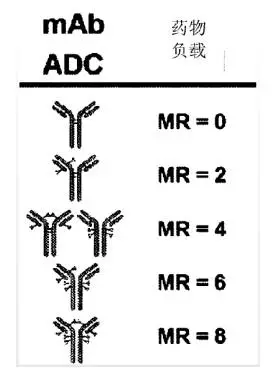
-?擁有不同的DAR與抗體連接位置(一般希望每個抗體連2-4個毒素)
(1)?連接物(Linker)選擇
連接物會極大影響ADC藥物的藥理動力性(釋放模式)、治療指數(shù)(TI,療效毒性比)與療效。理想化的連接物應(yīng)該保持穩(wěn)定所以不會導(dǎo)致靶外毒性(off-target toxicity),而且能在細(xì)胞內(nèi)快速解體高效釋放毒物。
連接物分為可降解cleavable與不可降解non-cleavable兩種。可降解連接物有二硫化物disulfides(含二硫鍵,在還原性胞內(nèi)環(huán)境中被谷胱甘肽glutathione選擇性降解,并且其空間位阻steric hindrance作用可限制ADCs在進入細(xì)胞之前的不成熟裂解)、腙hydrazone(含R1R2C=NNH,在溶酶體中的低PH值環(huán)境中降解)與多肽peptide(在溶酶體蛋白酶中降解)三種形式,不可降解連接物為硫醚thioethers(含R-S-R)。不可降解連接物的ADC中的抗體會在細(xì)胞中降解至氨基酸,生成的氨基酸-連接物-毒素會產(chǎn)生作用。可降解連接物ADC中的連接物會被降解,放出毒素,這會產(chǎn)生旁觀者殺傷(bystander?killing又稱旁效應(yīng)),攻擊附近的癌癥細(xì)胞。因此,使用可降解連接物對ADC在體內(nèi)循環(huán)時的穩(wěn)定性要求更高,但殺傷效果更好。?旁效應(yīng)還與毒素有關(guān),中性毒素(如MMAE,介紹在本章第4部分)比帶電荷毒素(如MMAF)強。
(2)?連接方式及DAR
另一重點為抗體上連接的毒素的個數(shù)(Drug-antibody Ratio, DAR),決定了藥品的均一性。個數(shù)過高會導(dǎo)致藥理動力性不穩(wěn)定、藥物代謝速度增加、半衰期減少和全身毒性的增加。DAR由連接方式?jīng)Q定。目前上市藥物使用的連接方式會產(chǎn)生許多含太大DAR的非均勻ADC藥物,所以穩(wěn)定地生產(chǎn)均勻藥物較為重要。化學(xué)生產(chǎn)控制(CMC)對于ADC非常重要,需要特殊的設(shè)備來保證質(zhì)量、穩(wěn)定性與每批產(chǎn)品的連貫性。
DAR受許多因素影響,但目前一般生產(chǎn)中會控制產(chǎn)量在3或4最大。這樣會使產(chǎn)品中混雜的未連接的純單抗雜質(zhì)比例最小、保證了產(chǎn)品的循環(huán)時間接近純單抗的循環(huán)時間、保持了ADC中單抗部分對靶點蛋白的吸附能力以及保證了ADC中連接的毒素足夠有效。生產(chǎn)后的純化工藝一般會將DAR<2或>4的藥品除去。Seattle?Genetics在國內(nèi)的專利中有關(guān)于純化時挑選DAR的技術(shù)。
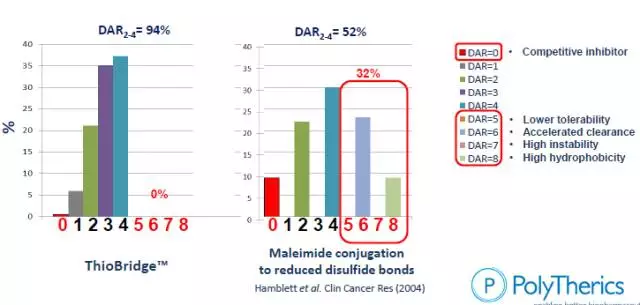
下圖為不同連接方式產(chǎn)生的產(chǎn)品中的純度。圖a連接在了lysine上,抗體上80個lysine中有大約30個可供連接,因此成品不太均勻。圖b連接在了cysteine上,只有4個interchain?disulfide?bridge,可連8個毒素,更加均勻(雙硫鍵要么不斷,斷了就要兩邊各連一個毒素)。圖c是將抗體上的的cysteine數(shù)量修改后的結(jié)果,這種抗體稱為THIOMAB。其他還有cross-link技術(shù),能夠?qū)AR=2~4的比例升為94%(見本章第(3)節(jié))。
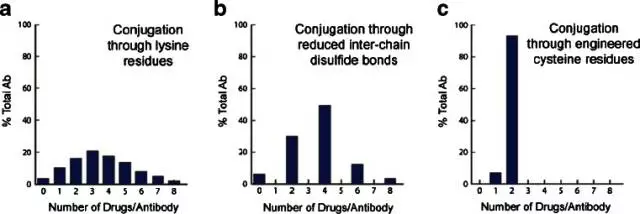
(3)?新技術(shù)Abzena的ThioBridge

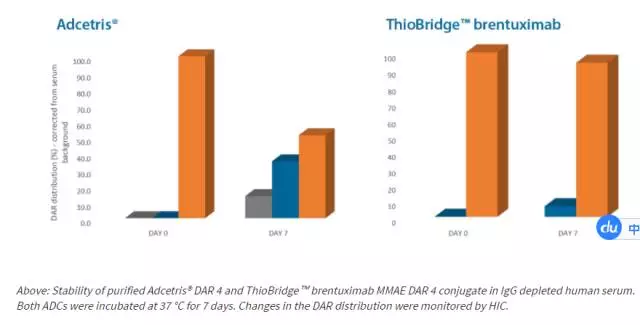
3、?毒素部分
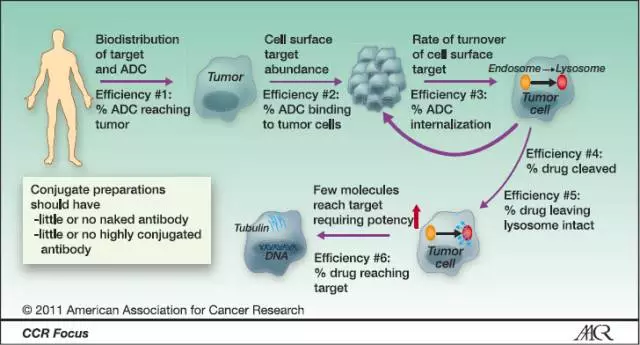
下圖為ADC藥物作用時的效率演示。由于ADC藥物產(chǎn)生作用的步驟較多,如果每步效率為50%,則最終僅有1.56%的dose起作用。因此,ADC藥物對每個分子連接的毒素效力有很高的要求。目前ADC使用的毒素效力為早期的100至1000倍。
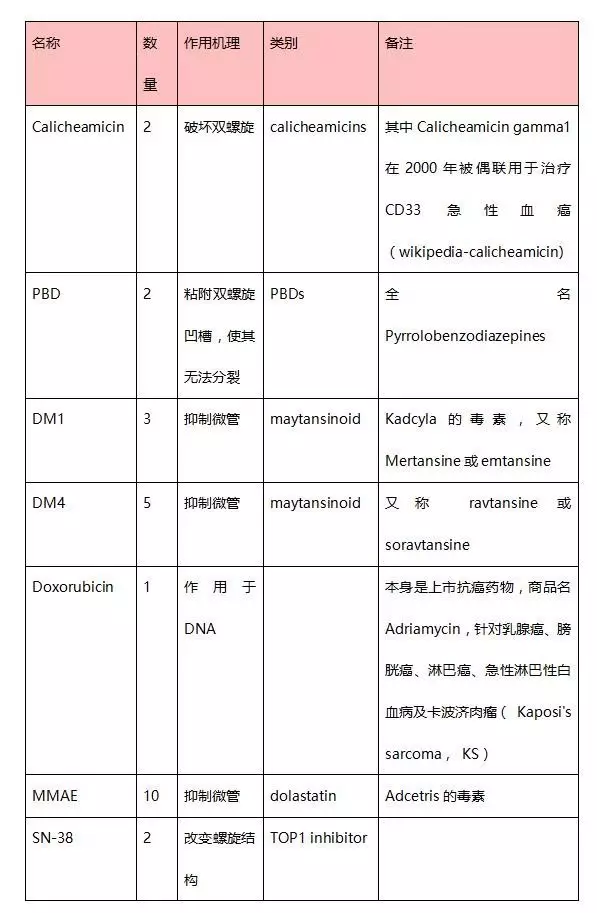
4、 核心專利-連接物與毒素排序
ADC藥物的抗體種類(大分子部分)是無限的,連接物、連接方式及毒素的種類(小分子部分)是有限的。作為核心要素,連接物-毒素化合物已經(jīng)被藥企申請了專利。目前FDA臨床的各種Linker-drug組合均可歸入以下幾種:A)?vc-MMAEB)?mc-MMAF
C)?mc-va-PBD
D)?mcc-triazole?spacer-PEG7-x-lysine-PABC-SN-38
E)?mcc-hydrazone linked-doxorubicin
F)?Novel Cysteine Cross-Linkers
G)?MCC-DM1與SPDB-DM4
H)?AcBut-N-Ac-γ-calicheamicin
由于篇幅有限,無法在本文中對每種連接物-毒素組合進行詳細(xì)的描述分析。有興趣的讀者可以閱讀這篇論文,其中對每種的結(jié)構(gòu)、特點、開發(fā)者及使用的藥物有詳盡的分析-?Nareshkumar Jain & Sean W. Smith & Sanjeevani Ghone & Bruce Tomczuk:?Current ADC Linker Chemistry
下表為不同不同linker-drug組合方式被臨床ADC選擇的數(shù)量。由此可見,peptide方式是主流。Peptide能夠被蛋白酶分解,進入細(xì)胞后起作用較快,殺死細(xì)胞后還能夠?qū)χ車?xì)胞進行殺傷。Peptide連接auristatin與cysteine被較為廣泛地使用。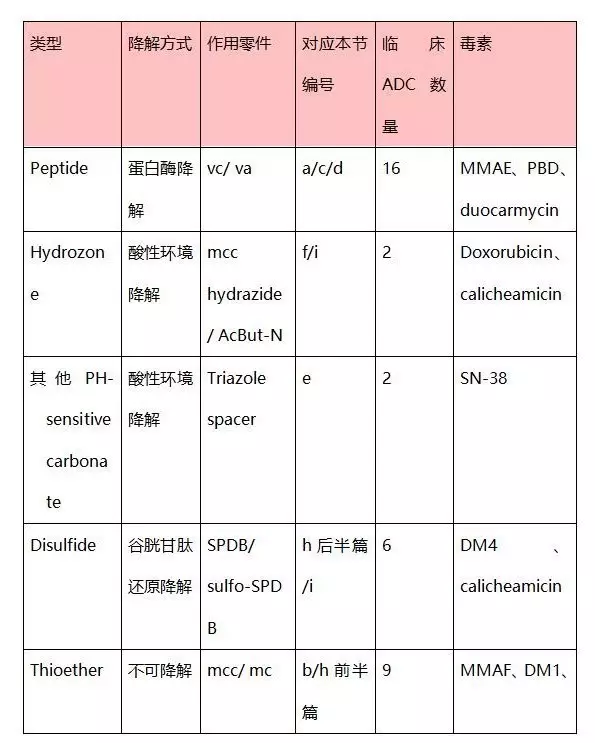 ‘三、效果對比
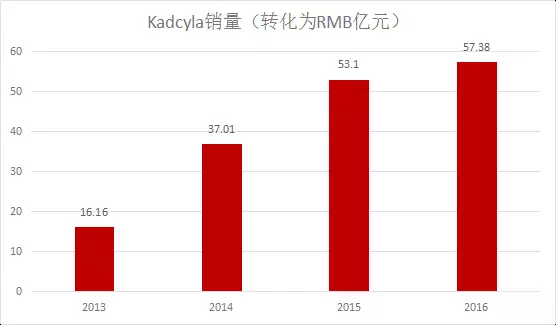
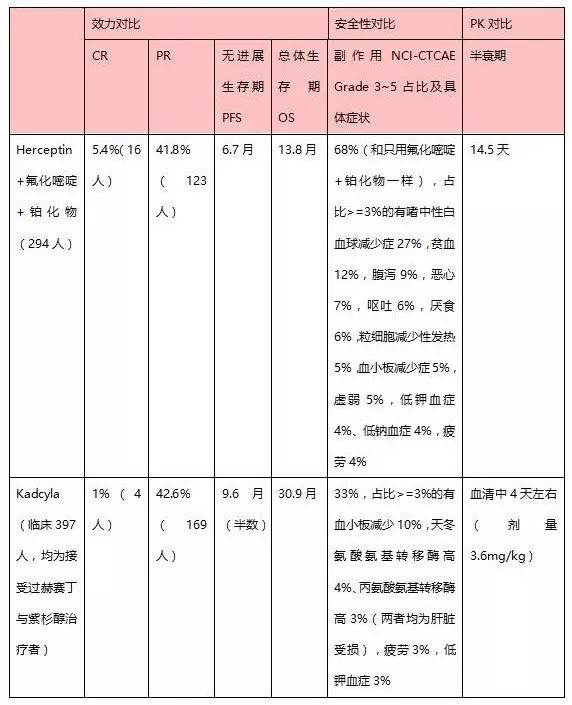
‘三、效果對比


Kadcyla對比Herceptin
四、?核心公司競爭情況
1、?領(lǐng)先公司
ADC領(lǐng)域成功公司主要為Seattle?Genetics、ImmunoGen、Immunomedics與Roche旗下Genentech四家。四家公司有大量互相技術(shù)授權(quán)與合作開發(fā)。作為行業(yè)領(lǐng)先公司,其核心團隊的構(gòu)成有一定特點。由于篇幅有限,本篇中不會展開,感興趣的讀者可以去相應(yīng)公司的官網(wǎng)查看。在最后一章中會對團隊情況做個總結(jié)。
(1)?Seattle Genetics
Seattle Genetics是一家納斯達克上市企業(yè)。作為ADC第一個開發(fā)出上市藥物Adcetris的公司,Seattle?Genetics一直只專注于ADC藥物領(lǐng)域,在ADC技術(shù)上一直處于領(lǐng)先地位。目前Seattle?Genetics擁有臨床期ADC藥物10個,并與Celldex、GeneTech、Abbvie、Progenics、Astellas、Bayer、GSK與Genmab合作,或授權(quán)或合作開發(fā)了14款A(yù)DC藥物。
除開發(fā)藥物外,Seattle?Genetics還進行ADC新毒素、連接物、抗體、抗體改造技術(shù)研發(fā)及新靶點的嘗試。在毒素上,Seattle?Genetics在嘗試多種新auristatin及其他類別的藥物;在連接物上,Seattle?Genetics的方向為開發(fā)在血中更穩(wěn)定在細(xì)胞中釋放毒素更有效的系統(tǒng);在抗體開發(fā)及新靶點嘗試上,Seattle?Genetics自己開發(fā)針對新靶點的藥物并從學(xué)術(shù)團體及生物醫(yī)藥公司引進技術(shù)目前正與Agensys及OxfordBiotherapeutics合作;在抗體修飾技術(shù)研究方面,Seattle?Genetics進行抗體人源化、抗體去巖藻糖基化(增強ADCC)及改變抗體連接linker的位點的類型及數(shù)目(THIOMAB),能夠改善偶聯(lián)ADC時的效率及繁瑣程度。
Seattle?Genetics成立于1998年,總部位于西雅圖,2001年Nasdaq上市,有800名成員。其唯一產(chǎn)品Adcetris在65個國家銷售,其中美國加拿大的商業(yè)化權(quán)利歸Seattle?Genetics,其他國家歸武田。除日本的發(fā)展花費由武田支付外,其他國家的花費由兩公司平攤。
(2)?ImmunoGen
ImmunuoGen是納斯達克上市企業(yè)。ImmunoGen的技術(shù)被用于Roche/Genetech的Kadcyla的研發(fā)上。其技術(shù)授權(quán)給了安進、Genetech/Roche、禮來、諾華、薩諾菲和武田。由ImmunoGen或授權(quán)技術(shù)的主要ADC臨床藥物有以下一些(部分臨床1期藥物不算)。
(3)?Immunomedics

2、?規(guī)模較大公司
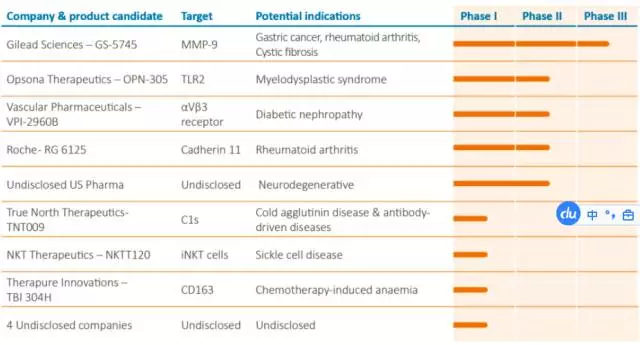
(1)?Abzena
其前身為2001帝國理工與UCL共同成立的ADC研發(fā)公司Polytherics,后來不斷與其他公司合并后于2014年以Abzena的名字在倫敦上市。其擁有獨門的ThioBridge技術(shù),能夠同時增加ADC藥物的均一性與穩(wěn)定性。其目前還有CMO與CRO業(yè)務(wù)。Abzena在抗體人源化與去免疫性領(lǐng)域也有獨到技術(shù)。目前有12個產(chǎn)品用了Abzena的人源化技術(shù),Anzena能夠從中獲得授權(quán)費、里程碑費用及忠誠度。其管線如下:
(2)?Agensys

(3)?Celldex

(4)?Progenics Pharmaceuticals

(6)?Sorrento旗下Concortis
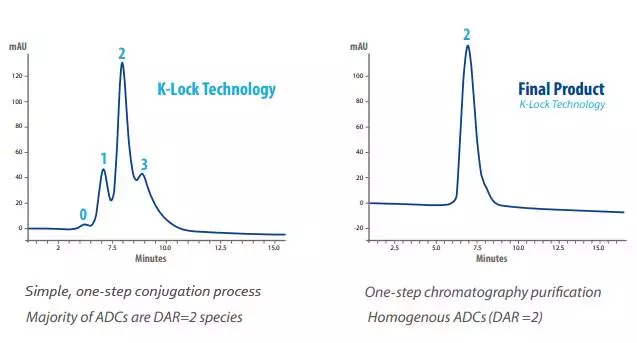


3、?大型藥企在ADC領(lǐng)域的布局
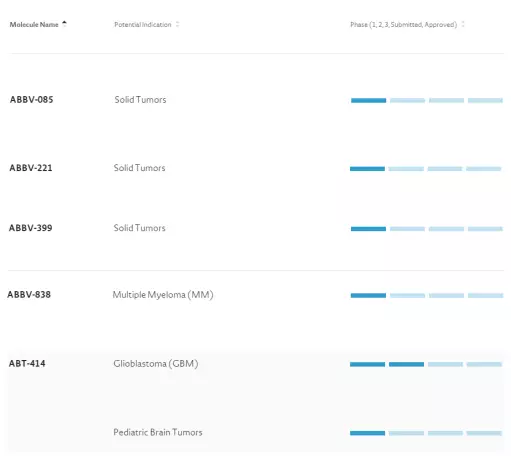
(1)?Abbvie及其旗下Stemcentrx
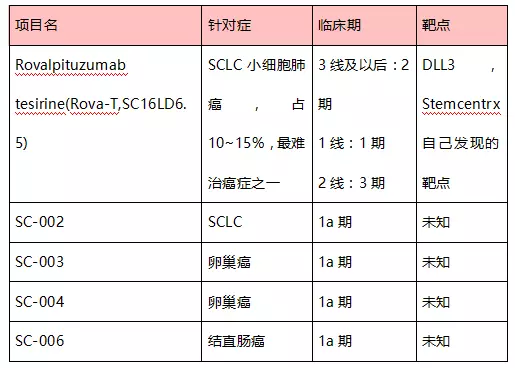
Stemcentrx成立于2008年,擁有研發(fā)與生產(chǎn)能力。其產(chǎn)品針對導(dǎo)致癌癥轉(zhuǎn)移的Cancer?Stem?Cells,具體方法是針對Stem?Cell上其自行發(fā)現(xiàn)的靶點DLL3、PTK7與EFNA4。2016年4月28日Abbvie宣布并購Stemcentrx,總花費10.2bn美元(包括未來里程碑時給原股東花費)。Stemcentrx的臨床產(chǎn)品管線如下,均為ADC。
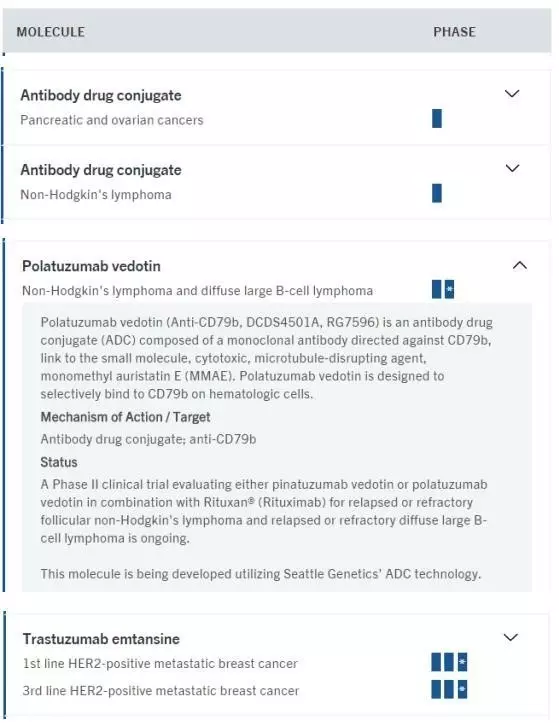
(2)?Roche旗下Genetech的情況
Genetech是重組DNA領(lǐng)域的先驅(qū)與領(lǐng)導(dǎo)者,由創(chuàng)投人Robert?A. Swanson與生物化學(xué)家Herbert Boyer成立,2009年由羅氏以468億美元收購。擁有美羅華、赫賽丁、索雷爾、阿瓦斯丁等暢銷藥物。擁有臨床期ADC藥物9個。其ADC產(chǎn)品管線如下:

(3)?武田旗下Takeda?Oncology

(4)?輝瑞ADC產(chǎn)品MylotargMylotarg
(5)?復(fù)星、藥明、浙江醫(yī)藥與Ambrx
2015年5月,由上海復(fù)星醫(yī)藥集團、厚樸投資、光大控股醫(yī)療健康基金以及藥明康德組成的聯(lián)盟宣布與美國Ambrx公司簽訂協(xié)議,根據(jù)協(xié)議上述機構(gòu)將對Ambrx公司展開聯(lián)合收購。在得到相關(guān)監(jiān)管部門的批準(zhǔn)且成交條件許可后,該交易預(yù)計將在2015年第二季度完成。
2016年8月,Ambrx宣布完成 4500 萬美元 E 輪融資,本輪融資由 Apricot Capital?和 Northeast Securities Prosperity Healthcare Fund 共同領(lǐng)投,中國國藥集團資本管理有限公司、人福醫(yī)藥集團股份公司及現(xiàn)有投資者上海復(fù)星醫(yī)藥、厚樸基金(HOPU Investments)和光大控股參投。
Ambrx擁有1個與浙江醫(yī)藥一起開發(fā)的臨床ADC藥物ARX778。Ambrx的定點偶聯(lián)技術(shù)通過引入非天然氨基酸實現(xiàn)(non-native?amino?acid),技術(shù)源自Scripps研究所首席執(zhí)行官Peter G Schultz教授。Ambrx的現(xiàn)任高管CEO喬鐵成、CSO Feng Tian博士、CMO 黑永疆博士均為華人。


(6)?三生制藥及三生國健
(7)?麗珠醫(yī)藥集團旗下麗珠單抗
上海美雅珂生物技術(shù)有限責(zé)任公司為中美合資創(chuàng)辦,成立于2014年初,是上市公司四川恒康集團公司的子公司,選址在張江高科技園區(qū),目前建有一千平米的辦公區(qū)和潔凈實驗區(qū)。 公司無官網(wǎng)。
美雅珂生物的ADC藥物MRG003于今年8月遞交IND申請,應(yīng)該是前期兄弟公司津曼特生物(四川恒康子公司)的EGFR單抗加上小分子藥物CPT-11。
公司核心管理團隊成員均來自于美國GSK, SeattleGenetic等著名跨國生物制藥企業(yè),致力于ADC的研發(fā),臨床研究及產(chǎn)業(yè)化。
(10)?其他藥企
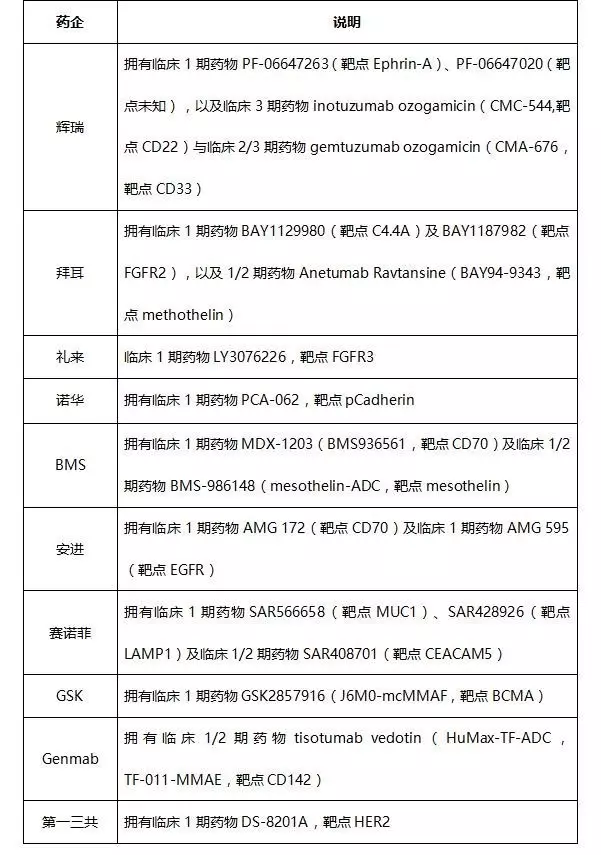
五、?行業(yè)市場規(guī)模
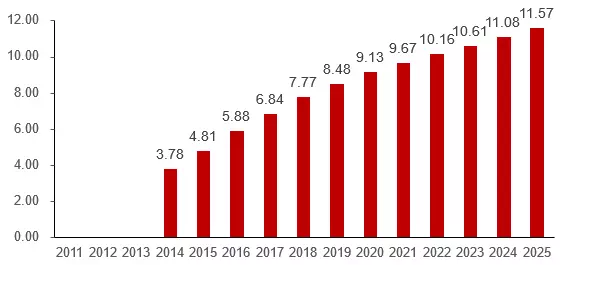
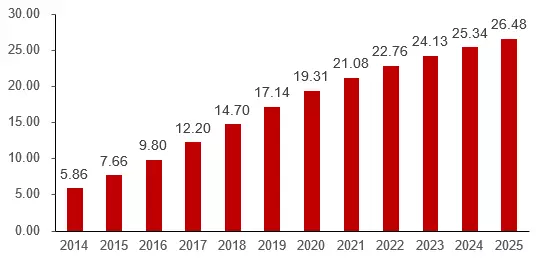
六、?ADC成功要素分析
凱泰資本生物技術(shù)團隊認(rèn)為成功的ADC公司有以下特點:1、獨家技術(shù):擁有獨家技術(shù),其可以是連接點技術(shù)(lysine、cysteine、cross-link、thiomab等)、連接物-毒素組合、新靶點(如DLL3)、非天然氨基酸剪輯技術(shù)等。最好在生產(chǎn)的均一性(DAR分布)與血清中穩(wěn)定性中存在優(yōu)勢。2、優(yōu)秀團隊:擁有優(yōu)秀的研發(fā)團隊,核心人員包括化學(xué)、抗體發(fā)現(xiàn)、腫瘤生物學(xué)與CMC四方面。3、研發(fā)方向:研發(fā)方向方面,最好選擇無有效藥物的針對癥的新靶點,或者熱門單抗藥的二線藥物進行研究,并且靶點的生物學(xué)機制清晰。
- http://www.clinicaltrials.gov/
- http://www.chinadrugtrials.org.cn/
- http://www.scripps.edu/baran/images/grpmtgpdf/Sella_May_14.pdf/
- http://medhum.med.nyu.edu/view/10059/
- https://en.wikipedia.org/wiki/Gemtuzumab_ozogamicin/
- http://www.sohu.com/a/157632636_119995/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4596905/
- http://www.abzena.com/development-services/bioconjugation/antibody-drug-conjugation/thiobridge-conjguation-technology/
- Seattle Genetics, ImmunoGen, Immunomedics, Abzena, Agensys, Celldex, Progenics, Genmab, Sorrento, Abbvie, Genentech, 麗珠單抗等公司官方網(wǎng)站
- EMA-Assessment?Report?for?Herceptin
- EMA-Assessment?Report?for?Kadcyla
- Nareshkumar Jain,?Sean W. Smith, Sanjeevani Ghone and Bruce Tomczuk: Current ADC Linker Chemistry
- Nikolaos Diamantis and Udai Banerji:?Antibody-drug conjugates—an emerging class of cancer treatment
- Beverly A. Teicher and Ravi V.J. Chari: Antibody conjugate therapeutics: challenges and potential
- Kyoji Tsuchikama and?Zhiqiang An: Antibody-drug conjugates: recent advances in conjugation and linker chemistries
- 衣常紅、高春芳: IgG糖基化修飾及其意義研究進展
- Alain Beck1, Liliane Goetsch1, Charles Dumontet2–4 and Nathalie Corva?a:Strategies and challenges for the next generation of antibody–drug conjugates?
- Polymetrics ppt
- 醫(yī)藥魔方-銷售數(shù)據(jù)
- Seattle Genetics 2015; Takeda 2015; visiongain2015;Roche 2015,湯森路透報告
★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源