
開發(fā)抗體藥物偶聯(lián)(ADC)藥物的技術(shù)挑戰(zhàn)(一):申報和監(jiān)管的一些問題
無容置疑,抗腫瘤免疫療法(I-O)是當(dāng)下制藥工業(yè)最熱門的研究領(lǐng)域。美中藥源在昨天甚至把這個領(lǐng)域的重中之重—嵌合抗原受體T細(xì)胞療法(CAR-T)比作“醫(yī)藥界的阿波羅11”,是最有希望治愈癌癥的一個顛覆性科學(xué)突破。不過中國制藥工業(yè)要稍微慢半拍,雖然也有象江蘇恒瑞、百濟(jì)神州這樣的中國藥企緊隨國際抗腫瘤免疫療法大潮流,開發(fā)了自主知識產(chǎn)權(quán)的抗PD-1/PD-L1抗體,恒瑞最近還把其抗PD-1抗體轉(zhuǎn)讓給美國Incyte制藥公司,但更多的中國藥企對另一個如火如荼的一類抗腫瘤新藥—抗體藥物偶聯(lián)(ADC)藥物的開發(fā)更情有獨鐘。繼江蘇恒瑞在2013年4月向國家食品藥品監(jiān)管局提交了首個基于曲妥珠單抗和DM1的ADC藥物(SHR-A1201)的臨床實驗申報(IND)之后,包括煙臺榮昌制藥的“注射用重組人源化抗HER2單抗-MMAE偶聯(lián)劑”(RC48)等多個ADC類藥物也向CFDA提交了臨床申請。更多的研究機(jī)構(gòu)和制藥企業(yè)紛紛進(jìn)入或正在進(jìn)入ADC藥物研發(fā)領(lǐng)域。但是ADC藥物的開發(fā)涉及抗體、細(xì)胞毒素、以及復(fù)雜的化學(xué)偶聯(lián)技術(shù),從研發(fā)到監(jiān)管技術(shù)壁壘都遠(yuǎn)遠(yuǎn)高于其它小分子和生物制劑的開發(fā)。考慮到一些企業(yè)和研究機(jī)構(gòu)對ADC藥物開發(fā)的技術(shù)挑戰(zhàn)估計不足,筆者準(zhǔn)備在今后的一段時間內(nèi)陸續(xù)和讀者探討一些ADC藥物開發(fā)當(dāng)中可能遇到的技術(shù)問題。
1、ADC以哪類藥物申報?
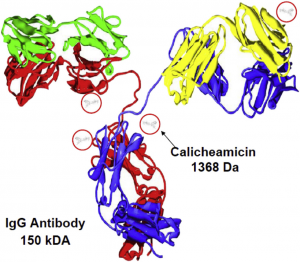
絕大多數(shù)的ADC藥物是由靶向腫瘤細(xì)胞表面抗原的單克隆抗體和細(xì)胞毒素通過接頭(也稱連接器)偶聯(lián)而成。圖1是首個上市ADC藥物Mylotarg(輝瑞,在2000年獲得FDA批準(zhǔn)上市,后在2010年自動撤市)的分子示意圖。因為通常ADC的主要作用機(jī)制是通過小分子效應(yīng)分子或彈頭來完成,而整個ADC又是一個大分子化合物,所以對ADC到底應(yīng)該屬于哪類藥物的認(rèn)定比較復(fù)雜(按定義應(yīng)該以主要作用機(jī)制為準(zhǔn)但ADC的確是大分子化合物)。美國FDA對ADC藥物的監(jiān)管程序也隨著時間推移發(fā)生過一些變化,在2003年之前ADC由藥物評價和研究中心(Center for Drug Evaluation and Research,CDER)評審(根據(jù)主要作用機(jī)制是小分子化藥),而在2003年之后,ADC藥物被視為和單克隆抗體藥物相同,都由生物制劑評價和研究中心(Center for Biologics Evaluation and Research,CBER)評價。所以,F(xiàn)DA在2000年以化藥這個主要作用模式批準(zhǔn)了史上第1個ADC藥物gemtuzumab ozogamicin的新藥申報(NDA,商品名Mylotarg),而在2011年和2013年分別作為大分子生物藥批準(zhǔn)了西雅圖遺傳的brentuximab vedotin(商品名Adcetris)和基因泰克的traztuzumab emtansine(商品名Kadcyla)的生物制劑許可(BLA)。
2、ADC作為生物制劑在美國是否享有12年市場獨占期?
美國FDA依據(jù)“公共健康服務(wù)法”(PHSA)和在2010年補充頒布并作為平價醫(yī)療法案一部分的“生物制劑價格競爭和創(chuàng)新法案”(BPCIA)監(jiān)管ADC藥物的申報。因此ADC藥物的第一個BLA應(yīng)該享受12年市場獨占期,也就是說FDA在批準(zhǔn)一個BLA之后12年內(nèi)將不批準(zhǔn)其它生物仿制藥(ABLA)上市(FDA Guidance for Industry(August 2014);Reference Product Exclusivity for Biological Products Filed Under 351(a)of the PHS Act)。但是由于ADC藥物結(jié)構(gòu)復(fù)雜,主要作用模式通過小分子化藥完成,抗體主要起著靶向輸送作用,所以對ADC藥物是否是第一個BLA的認(rèn)定需要具體情況具體分析。比如Adcetris由抗CD-30單克隆抗體和細(xì)胞毒素MMAE連接組成,而CD-30和MMAE之前作為單藥使用從未獲得FDA批準(zhǔn)上市,所以Adcetris和其兩個組成部分從監(jiān)管角度都是全新的,毫無疑問是第一個BLA。盡管FDA到目前為止還沒有公布,但筆者相信Adcetris能獲得12年生物制劑的市場獨占期。但Kadcyla有所不同,雖然其效應(yīng)分子TM-1從未獲得FDA批準(zhǔn)上市,但其抗HER2抗體trastuzumab(商品名Herceptin)早在1998年就獲得FDA的生物制劑許可(BLA)。據(jù)此FDA可能不會認(rèn)定Kadcyla是首次BLA,無法享受生物制劑的12年市場獨占期。但是根據(jù)2014年10月的“Guidance for Industry:New Chemical Entity Exclusivity Determinations for Certain Fixed-Combination Drug Products”,Kadcyla也可以看做是trastuzumab和TM-1固定劑量的復(fù)方組合,而TM-1之前從未獲批上市,根據(jù)該項條款Kadcyla可以獲得NDA的5年市場獨占期。
所以,ADC是否享受生物制劑許可的12年市場獨占期將“因藥而定”,同時需要和FDA協(xié)調(diào),引用有利于藥廠的法律條款。比如如果能使FDA確信Kadcyla只是trastuzumab單抗的一個結(jié)構(gòu)修飾,并導(dǎo)致安全性、純度和活性的變化(me-better),則認(rèn)定是第一個BLA,應(yīng)該獎勵12年市場獨占期。
3、ADC藥物的申報由FDA的那個部門負(fù)責(zé),是ONDQA還是OBP?
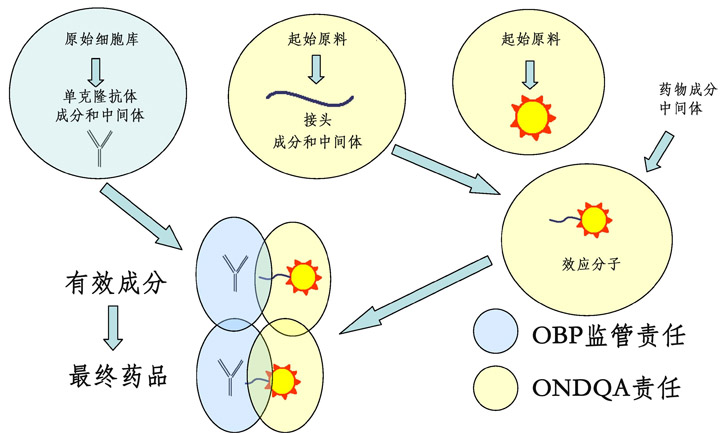
因為ADC藥物的結(jié)構(gòu)高度復(fù)雜,既要評價來自單克隆抗體部分的生物制品質(zhì)量,也要監(jiān)管來自細(xì)胞毒素,接頭、以及效應(yīng)分子(細(xì)胞毒素+接頭)等小分子部分的質(zhì)量屬性,還有最終產(chǎn)品ADC藥物的質(zhì)量控制。所以ADC藥物的評價由新藥質(zhì)量評價辦公室(Office of New Drug Quality Assessment,ONDQA)和生物制品辦公室(Office of Biological Products,OBP)協(xié)同完成。前者審查ADC的小分子部分(細(xì)胞毒素和接頭)、后者為單克隆抗體的發(fā)酵、細(xì)胞系(cell banking)、和結(jié)構(gòu)鑒定把關(guān)。兩個辦公室對最終產(chǎn)品(final drug substance,ADC DS)共同負(fù)責(zé)。圖2表明FDA的這兩個部門對ADC藥物審查的具體分工。
如圖2所示,OBP負(fù)責(zé)ADC藥物抗體部分的質(zhì)量審查,具體要求和對單克隆抗體的審批完全相同。這不僅包括MAb的一級、二級、和三級結(jié)構(gòu),糖基化程度、翻譯后修飾、片段或聚集體的檢驗、電荷和電荷變體的存在、以及對靶向抗原的親合力和特異性評價,也包括單抗或其中間體對FcγR和FcRn的親和力和效應(yīng)功能測定。而且因為一些單抗本身具有細(xì)胞毒性,所以對單抗或其中間體活性的鑒定不僅僅限于對靶向細(xì)胞內(nèi)的信號傳導(dǎo)。當(dāng)然病毒和宿主細(xì)胞的含量也必須定量分析。
ONDQA部分對ADC藥物的監(jiān)管也和對小分子新藥申報完全相同。這包括對細(xì)胞毒素、接頭、以及效應(yīng)分子(細(xì)胞毒素+接頭)的分子手性、光學(xué)純度、晶體形態(tài)、來自起始原料和中間體、生產(chǎn)過程中的所有雜質(zhì)、重金屬、催化劑、溶劑殘留物等。任何高于0.1%的雜質(zhì)(細(xì)胞毒素、接頭、以及效應(yīng)分子)都必須進(jìn)行結(jié)構(gòu)鑒定。
4、ADC藥物到底有多復(fù)雜,如何檢測?
ADC藥物非常復(fù)雜,其復(fù)雜程度遠(yuǎn)不止是一個小分子化藥和生物制劑的疊加。除了以上OBP負(fù)責(zé)的單抗部分和ONDQA負(fù)責(zé)的小分子部分之外,OBP和ONDQA共同監(jiān)控最終ADC藥物的產(chǎn)品質(zhì)量。雖然通常檢測ADC藥物純度的方法和單抗相同(SDS-PAGE/CGE,SEC-HPLC),但ADC藥物有其特殊性,比如ADC藥物經(jīng)常出現(xiàn)聚合(aggregation)而且包括效應(yīng)分子等片段(fragments)也可能脫落(不穩(wěn)定)。而且引入不同性質(zhì)以及個數(shù)的效應(yīng)分子對ADC藥物分子的大小、電荷、糖基化、以及活性和單抗本身相比會發(fā)生較大變化。ONDQA負(fù)責(zé)的兩個最重要的驗證性實驗有藥物-單抗比例(drug-antibody ratio,DAR)和藥物分布(drug distribution)。前者是連接到抗體藥物的平均比例,后者是含有1至多個藥物的分布。顯然,藥物偶聯(lián)的不確定性(heterogeneity of drug conjugation)還會因為糖基化的不確定性(heterogeneity of glycosylation)進(jìn)一步疊加,導(dǎo)致樣品分析更多的復(fù)雜性和挑戰(zhàn)(見圖3)。其中左圖是完整ADC的質(zhì)譜圖(糖基化),而右圖是一個脫糖基化ADC的質(zhì)譜圖,后者更清楚地顯示在ADC藥物中抗體攜帶藥物(美登素)的數(shù)目分布。但是,因為圖3是質(zhì)譜圖,其質(zhì)量分布只表明ADC藥物的分子量分布,而不是藥物對抗體連接位點的分布,所以實際情況更為復(fù)雜。
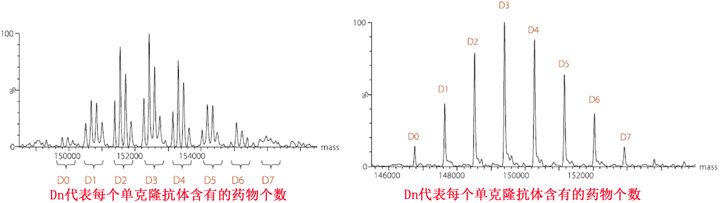
圖3、ImmunoGen的一個美登素ADC質(zhì)譜實例,比較糖基化單抗(左圖)和脫糖基化單抗(右圖)攜帶藥物的數(shù)目和分布(Copyright Solvias AG)
顯然,ADC藥物的分析方法必須精確分析DAR和藥物分布,常見分析方法有疏水作用層析(HIC)、UV/VIS光譜、UV-MALDI質(zhì)譜分析等,其中HIC常用于通過半胱氨酸偶聯(lián)的ADC。但是因為賴氨酸偶聯(lián)ADC的電荷異質(zhì)性,以上這些方法并不適用通過賴氨酸偶聯(lián)ADC的方法學(xué)建立,對這類ADC藥物的分析常常采用MALDI-TOF和ESI-TOF質(zhì)譜。
總之,ADC藥物非常復(fù)雜,無論是監(jiān)管還是生產(chǎn)工藝其復(fù)雜程度都高于傳統(tǒng)的生物藥和小分子化學(xué)藥。所以在進(jìn)入ADC研發(fā)領(lǐng)域之前,藥企不僅需要了解ADC藥物的市場競爭,制定適合自己的研發(fā)策略,也要充分考慮ADC藥物的研發(fā)、申報、和生產(chǎn)的技術(shù)壁壘。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

One Response to 開發(fā)抗體藥物偶聯(lián)(ADC)藥物的技術(shù)挑戰(zhàn)(一):申報和監(jiān)管的一些問題
發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源
Pingback: 聚焦生物類似藥(1): 何為生物類似藥? | 美中藥源