Chimerix公司抗病毒藥物Brincidofovir關(guān)鍵三期臨床失敗,股票暴跌81%
【新聞事件】:美國(guó)Chimerix公司今天公布,其口服抗病毒藥物Brincidofovir在一個(gè)預(yù)防造血干細(xì)胞移植(HCT)時(shí)的巨細(xì)胞病毒(CMV)感染的三期臨床試驗(yàn)(SUPPRESS研究)中沒有達(dá)到一級(jí)臨床終點(diǎn)。在造血干細(xì)胞移植后24周,治療組患者的死亡和巨細(xì)胞病毒感染數(shù)均大于對(duì)照組。盡管Chimerix暫停招募Brincidofovir兩個(gè)腎移植的三期臨床試驗(yàn)(SUSTAIN和SURPASS實(shí)驗(yàn)),但公司聲稱將繼續(xù)開發(fā)Brincidofovir預(yù)防嚴(yán)重腺病毒感染和天花病毒感染的晚期臨床研究。因?yàn)锽rincidofovir是Chimerix的唯一資產(chǎn),投資人反應(yīng)強(qiáng)烈,今天公司股票暴跌81%。
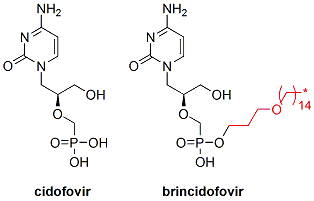
【藥源解析】:如下圖所示,Brincidofovir(之前稱CMX001,右圖)是抗病毒藥物西多福韋(cidofovir,左圖)的前藥。雖然西多福韋對(duì)巨細(xì)胞病毒、單純皰疹病毒、帶狀皰疹病毒、腺病毒、以及埃博拉病毒等表現(xiàn)良好的抑制活性,但其生物利用度差,而且只能靜注,尤其還有較嚴(yán)重的不可逆腎毒性限制了其更廣泛的使用。Brincidofovir作為西多福韋的前藥,旨在通過引入脂質(zhì)以便在細(xì)胞內(nèi)降解釋放有效活性成分西多福韋。這樣既提高了西多福韋對(duì)雙鏈DNA的活性又提高了口服生物利用度。與西多福韋相比,brincidofovir具有口服、對(duì)腎臟傷害較小等優(yōu)勢(shì)。在動(dòng)物實(shí)驗(yàn)中,Brincidofovir對(duì)巨細(xì)胞病毒、腺病毒、BK病毒、天花和單純皰疹病毒等表現(xiàn)良好的療效。而且盡管埃博拉病毒不是雙鏈DNA病毒,但體外實(shí)驗(yàn)證明Brincidofovir對(duì)埃博拉病毒表現(xiàn)較好的抑制活性。
雖然Chimerix是只有幾十個(gè)員工的小公司,但因?yàn)閎rincidofovir是埃博拉疫情中最早的治療選擇之一,令Chimerix廣為人知。尤其因?yàn)?歲腎癌兒童Josh Hardy的“同情用藥”事件更把Chimerix推到“道德”的風(fēng)口浪尖。甚至公司CEO Kenneth Moch因此在今年4月被迫離職。除此之外,brincidofovir的“快速通道”臨床試驗(yàn)也與眾不同,F(xiàn)DA迫于輿論壓力和藥廠一起加速brincidofovir的晚期臨床試驗(yàn)。
2014年初,美國(guó)一個(gè)自9個(gè)月大就羅患腎癌的7歲男孩Josh Hardy因多次治療導(dǎo)致免疫系統(tǒng)脆弱,隨后又受到腺病毒感染而生命垂危。為Josh治療的圣裘德兒童研究醫(yī)院(St. Jude Children’s Research Hospital)醫(yī)生告訴其父母,抗病毒新藥brincidofovir有望清除孩子的腺病毒。因?yàn)閎rincidofovir還處于臨床試驗(yàn)階段,要么參加臨床試驗(yàn),要么向FDA申請(qǐng)“同情使用”,“同情使用”是在沒有其它可行治療方案情況下,使用未獲準(zhǔn)投入臨床應(yīng)用的藥物對(duì)患者實(shí)施治療。但因?yàn)镃himerix是一個(gè)小公司,經(jīng)濟(jì)和人力上都已經(jīng)無法承擔(dān)更多“同情使用”要求而被拒絕。Josh的父母隨后在互聯(lián)網(wǎng)上發(fā)起“救救Josh”的請(qǐng)?jiān)感袆?dòng),而且該請(qǐng)?jiān)感袆?dòng)不僅獲得包括一些明星在內(nèi)的大批網(wǎng)友簽名,更獲得美國(guó)主流媒體的廣泛報(bào)道。在強(qiáng)大輿論壓力下,Chimerix與FDA溝通形成了一個(gè)“加速臨床試驗(yàn)”的解決方案。FDA同意立即批準(zhǔn)Chimerix為brincidofovir增加了一項(xiàng)臨床試驗(yàn),為包括Josh在內(nèi)的20名腺病毒感染患兒使用brincidofovir治療。4月9日,在Josh進(jìn)入brincidofovir試驗(yàn)三周后,公司CEO Kenneth Moch離職。
當(dāng)然brincidofovir的“同情使用”風(fēng)波和“快速臨床通道”與以上三期臨床結(jié)果沒有關(guān)系,該臨床試驗(yàn)的失敗又一次說明了新藥開發(fā)的復(fù)雜性。盡管brincidofovir只是老藥西多福韋的一個(gè)前藥,而且在體外、體內(nèi)實(shí)驗(yàn)中有效地降解成活性成分西多福韋,還在動(dòng)物實(shí)驗(yàn)中表現(xiàn)良好的抗病毒療效。事實(shí)上該SUPPRESS三期臨床的結(jié)果并非和之前的二期結(jié)果矛盾。該臨床試驗(yàn)結(jié)果的進(jìn)一步分析發(fā)現(xiàn),brincidofovir治療組患者在造血干細(xì)胞移植14周之內(nèi)患者的CMV感染數(shù)依然低于對(duì)照組,和之前的二期結(jié)果一致。但是14周至24周時(shí)治療組的CMV感染數(shù)大于對(duì)照組。雖然治療組患者的死亡率和對(duì)照組相比也有所上升但不具有統(tǒng)計(jì)學(xué)顯著。造成這個(gè)結(jié)果的主要原因可能是因?yàn)橹委熃M出現(xiàn)較多的移植物抗宿主病(GVHD)并使用過多的糖皮質(zhì)激素,這兩者都是導(dǎo)致晚期CMV感染增加的因素。下一步的臨床試驗(yàn)可能需要招募那些GVHD低風(fēng)險(xiǎn)患者,當(dāng)然也明顯降低了brincidofovir上市后的適用人群。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。



















 微信號(hào):美中藥源
微信號(hào):美中藥源