
要聞點評2013-1-29:中外制藥向日本監(jiān)管部門申報抗體藥物偶聯(lián)物(ADC)T-DM1
作者:朱貴東
【新聞事件】:據(jù)東京消息,中外制藥(Chugai Pharmaceutical)今天向日本衛(wèi)生、勞動和福利省(MHLW)遞交了抗體藥物偶聯(lián)物(ADC)trastuzumab emtansine(T-DM1)的新藥申請(NDA),用于治療人類表皮生長因子受體2(HER2)陽性的轉(zhuǎn)移或復(fù)發(fā)性乳腺癌。該新藥申報基于一個在日本之外進行的三期臨床實驗(EMILIA)和一個在日本本土進行的二期臨床實驗結(jié)果。前者代號為EMILIA的國際性三期臨床實驗頭對頭比較T-DM1單獨用藥與lapatinib(拉帕替尼)和capecitabine(卡培他濱)聯(lián)合用藥,用于治療轉(zhuǎn)移性或不可切除的局部晚期乳腺癌的療效。這些乳腺癌患者都是HER2陽性,并且之前接受過曲妥珠單抗和紫杉醇化療治療。該臨床實驗注冊有991位乳腺癌病人,其中不包含日本患者。無進展生存期(PFS)和總生存期(OS)是這個臨床實驗的主要觀察終點。結(jié)果發(fā)現(xiàn),T-DM1治療組的無進展生存期的中位數(shù)達到9.6個月,和拉帕替尼/卡培他濱聯(lián)合用藥組的6.4個月相比延長了35%,并且具有統(tǒng)計學(xué)有效。T-DM1治療組患者的總生存期和聯(lián)合用藥組相比也有顯著延長,從25.1個月增加至30.9個月,死亡風(fēng)險降低32%。不僅如此,T-DM1治療組發(fā)生三級以上的嚴重不良反應(yīng)的比率(41%)也較聯(lián)合用藥組低(57%),而且還能夠避免許多典型的細胞毒素藥物的副作用。然而,T-DM1組患者的血小板減少癥的發(fā)生頻率更高,當(dāng)對藥物劑量進行修飾后,絕大多數(shù)患者能夠繼續(xù)治療。在日本進行的二期臨床實驗的藥效和耐受性基本上和EMILIA實驗相同。
【相關(guān)事實】:
? 在所有乳腺癌患者中大約有百分之二十人類表皮生長因子受體2(HER2)呈陽性。
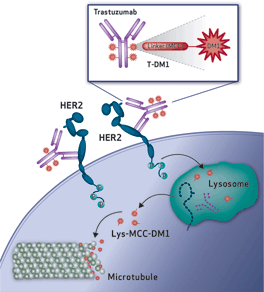
? Trastuzumab(曲拓珠單抗)是靶向HER2的單克隆抗體,T-DM1是把曲拓珠單抗和DM1采用ImmunoGen的穩(wěn)定型連接子連接而成。
? 之前,羅氏和基因泰克公司已經(jīng)向美國FDA遞交了T-DM1的生物制劑許可申請(BLA),向歐洲EMA遞交了上市申請。美國FDA已經(jīng)授予T-DM1的優(yōu)先審查資格,并定于2013年2月26日給予答復(fù)。
? 2010年FDA曾拒絕了羅氏和基因泰克公司遞交的Trastuzumab-DM1(T-DM1)的生物制品申報(BLA)的加速審批。
? Dako HercepTest抗體與HER2 FISH pharmDx檢測試劑將作為T-DM1的搭配診斷試劑。
【藥源解析】:T-DM1是到目前為止第三個申報上市的抗體藥物偶聯(lián)物(ADC)。Mylotarg(Gemtuzumab Ozogamicin)于2001年被美國FDA批準有條件上市但附帶黑框警告,因為副作用于2010年撤市。西雅圖遺傳的Adcetris的上市才真正展示ADC類藥物的成功,推動了全球抗體藥物偶聯(lián)物研發(fā)的高潮,到目前為止至少有39個ADC藥物處于不同的臨床實驗階段。
結(jié)構(gòu)上T-DM1把基因泰克公司的HER2靶向抗體trastuzumab采用ImmunoGen公司的TAP專利連接技術(shù)連到高活性抗有絲分裂化合物DM1上。羅氏公司在2010年曾基于T-DM1的二期臨床實驗結(jié)果向美國FDA提出上市申請,但被拒絕。FDA專家認為T-DM1申報的臨床試驗結(jié)果因為既沒有包括HER2的檢測也沒有包括和目前標(biāo)準療法的直接比較,不能滿足FDA加速審評的要求。
發(fā)表在2012年11月8日《新英格蘭醫(yī)學(xué)雜志》上的T-DM1三期臨床實驗結(jié)果證明,T-DM1和拉帕替尼/卡培他濱聯(lián)合用藥組相比顯示明顯優(yōu)勢,有望成為人類表皮生長因子受體2(HER2)陽性乳腺癌的一線療法。
另外,EMILIA三期臨床所證實的T-DM1的藥理學(xué)特征也值得重視。腫瘤病理切片以及之前動物模型試驗中的數(shù)據(jù)顯示,對曲妥珠單抗治療產(chǎn)生抵抗性的患者人群中HER2受體數(shù)量和功能均未受到損傷性影響。內(nèi)臟轉(zhuǎn)移灶腫瘤的消退指明,釋放的細胞毒 maytansinoid在細胞內(nèi)的聚集濃度足以導(dǎo)致細胞因有絲分裂障礙而死亡,并且沒有出現(xiàn)曲妥珠單抗單藥治療時經(jīng)常發(fā)生的腫瘤生長遲緩(cytostasis)。這樣,T-DM1和設(shè)計原理完全相同,既保留了曲妥珠單抗的作用之外又增加了潛在的細胞毒素藥物的效應(yīng)。
【未來影響】:如果不出意外,T-DM1應(yīng)該在短期內(nèi)在美國、日本和歐洲上市。T-DM1的成功至少在兩方面表現(xiàn)重要意義:(一)Mylotarg和Adcetris都是靶向血液腫瘤細胞表面抗原(CD33和CD30),到目前為止顯示明顯療效的臨床實驗也局限于血液腫瘤。而T-DM1是靶向固體腫瘤細胞。理論上講,固體腫瘤組織更復(fù)雜,給ADC藥物的滲透造成更多困難;(二)T-DM1的接頭是由穩(wěn)定的硫醚健連接,被腫瘤細胞吞噬后釋放了仍然帶有接頭片段但具有同等活性的美登素細胞毒,同時也表明這類ADC藥物在細胞外沒有釋放細胞毒。T-DM1明顯的臨床療效證明,細胞內(nèi)或細胞表面裂解接頭不是ADC藥物設(shè)計的必要條件,但其對各類腫瘤細胞的廣譜性有待確認。
【藥源相關(guān)報道】(因網(wǎng)站文章整理進行中,以下鏈接會盡快補上,敬請諒解)
要聞點評2013-1-24:西雅圖遺傳和千禧制藥啟動Adcetris的又一個三期臨床,治療表達CD30的成熟T-細胞淋巴瘤(MTCL)
藥源點評2012-12-21:抗體藥物偶聯(lián)物(ADC)
Synthon生物制藥公司的抗體藥物偶聯(lián)物(ADC)在臨床前實驗中顯示積極療效
★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源