盤點(diǎn)2013年上半年美國(guó)FDA批準(zhǔn)的新藥
作者:呂順
受《美中藥源》委托,筆者對(duì)美國(guó)FDA在今年1-6月份批準(zhǔn)的新藥稍作整理、匯總。列表內(nèi)容包括商品名、通用名、研發(fā)公司、可能的作用機(jī)制、適應(yīng)癥以及美國(guó)FDA批準(zhǔn)的日期。對(duì)每一種新藥根據(jù)個(gè)人體會(huì)還作了一點(diǎn)簡(jiǎn)單介紹,如有不準(zhǔn)確的地方歡迎批評(píng)指正。
美國(guó)FDA在2013年1-6月份批準(zhǔn)的新藥
|
商品名
|
通用名/曾用名
|
研發(fā)公司
|
作用機(jī)制
|
適應(yīng)癥
|
批準(zhǔn)日期
|
|
Nesina
|
Alogliptin(阿格列汀)
|
武田制藥
|
DPP4抑制劑
|
II型糖尿病
|
2013年1月25日
|
|
Kynamro
|
Mipomersen(米泊美生鈉)
|
健贊/ISIS
|
反譯RNA靶向B-阿樸脂蛋白
|
純合家族高血脂癥(HoFH)
|
2013年1月29日
|
|
Pomalyst
|
Pomalidomide(泊利度胺)
|
塞爾基因(Celgene)
|
免疫調(diào)節(jié)劑
|
多發(fā)性骨髓瘤
|
2013年2月8日
|
|
Kadecyla
|
Ado-trastuzumab emtansine (T-DM1)
|
Immunogen/羅氏
|
抗體藥物偶聯(lián)物(ADC)靶向人類表皮生長(zhǎng)因子受體
|
HER-2陽(yáng)性轉(zhuǎn)移性乳腺癌
|
2013年2月22日
|
|
Osphena
|
Ospemifene
|
鹽野義制藥
|
雌激素激動(dòng)劑或拮抗劑
|
因絕經(jīng)而引起的性交疼痛
|
2013年2月26日
|
|
Lymphoseek
|
Technetium Tc-99m tilmanocept
|
Navidea生物制藥公司
|
淋巴繪圖造影劑
|
乳腺癌/黑色素瘤淋巴結(jié)定位
|
2013年3月13日
|
|
Dotarem
|
Gadoterate meglumine(釓特酸葡甲胺)
|
Guerbet公司
|
含釓MRI造影劑
|
腦部、脊柱及相關(guān)組織的核磁共振成像
|
2013年3月20日
|
|
Tecfidera
|
Dimethyl fumarate(富馬酸二甲酯)
|
Biogen公司
|
核轉(zhuǎn)錄因子-kB(NF-kB)抑制劑
|
多發(fā)性硬化癥
|
2013年3月27日
|
|
Invokana
|
canagliflozin
|
Janssen/強(qiáng)生
|
SGLT2抑制劑
|
II型糖尿病
|
2013年3月29日
|
|
Breo Ellipta
|
Fluticasone furoate+vilanterol trifenatate(糠酸氟替卡松+維蘭特羅吸入性粉劑)
|
葛蘭素史克
|
糖皮質(zhì)激素+β2腎上腺素受體激動(dòng)劑
|
慢性阻塞性肺病
|
2013年5月10日
|
|
Xofigo
|
Radium Ra-223 dichloride(二氯化鐳)
|
拜耳公司
|
二氯化鐳223
|
晚期前列腺癌
|
2013年5月15日
|
|
Tafinlar
|
Dabrafenib
|
葛蘭素史克
|
BRAF抑制劑
|
BRAF突變的晚期黑色素瘤
|
2013年5月29日
|
|
Mekinist
|
Trametinib
|
葛蘭素史克
|
MEK1/MEK2抑制劑
|
BRAF突變的晚期黑色素瘤
|
2013年5月29日
|
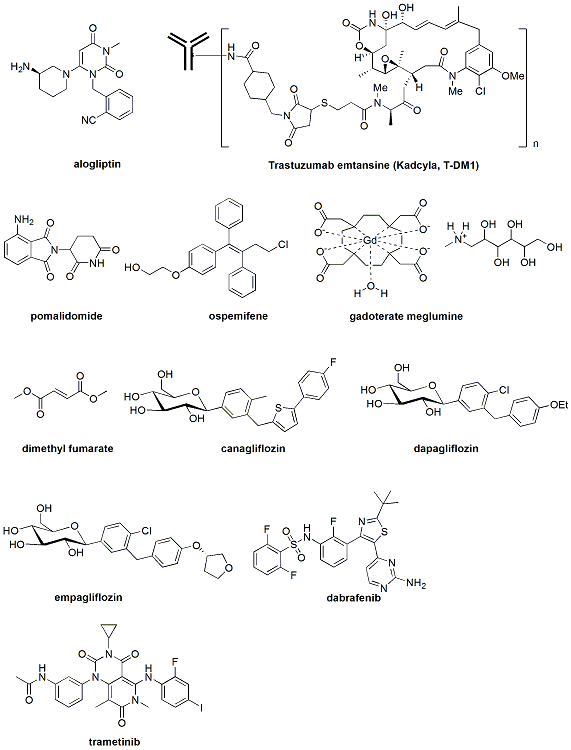
Nesina(通用名:Alogliptin,阿格列汀)
二肽基肽酶-4(Dipeptidyl Peptidase 4,DPP-4)是九十年代末至二十一世紀(jì)初最熱門的靶點(diǎn)之一。選擇性地抑制DPP-4,可以升高內(nèi)源性胰高血糖素樣肽-1(Glucagon-like Peptide-1,GLP-1)和葡萄糖依賴性促胰島素釋放多肽(Glucose-dependent Insulinotropic Peptide,GIP)的水平,從而達(dá)到降糖效果。雖然DPP4抑制劑在動(dòng)物模型的療效一般,但諾華首次把Vidagliptin推向臨床,并顯示較好療效,立即引來(lái)無(wú)數(shù)跟隨者。DPP4抑制劑可能是過(guò)去十年最受藥廠青睞的me-too項(xiàng)目,至少有包括恒瑞的瑞格列汀在內(nèi)的18個(gè)DPP4抑制劑獲得藥監(jiān)部門的臨床批件。 上市的DPP4抑制劑有Sitagliptin(2006,默克)、Vildagliptin(歐共體2007,諾華)、Saxagliptin(2009,Onglyza)、Linagliptin(2001,禮來(lái)和BI)、Anagliptin(日本2012,三和)、和Aligoliptin(2013,武田)。據(jù)說(shuō)默克在2001年才開始DPP4項(xiàng)目,但后來(lái)居上并于2006首次在美國(guó)上市,堪稱me-too藥研發(fā)的典范。Sitagliptin在2012年的全球銷售額高達(dá)57億美元(含Janumet聯(lián)合用藥)。
Nesina 是阿格列汀的單方制劑,于2010 年4月獲得日本衛(wèi)生勞動(dòng)福利部批準(zhǔn),2010 年6 月在日本上市。武田公司早在2007年就提請(qǐng)美國(guó)FDA 審批,但由于該藥可能增加心臟和其他器官病變的風(fēng)險(xiǎn)而被否決。隨后阿格列汀的申報(bào)一波三折終于在今年一月份被FDA放行。即使如此,F(xiàn)DA 還要求針對(duì)Nesina 開展包括心血管結(jié)局試驗(yàn)、肝臟異常監(jiān)測(cè)、胰腺炎和超敏反應(yīng)的風(fēng)險(xiǎn)等多項(xiàng)上市后研究。《美中藥源》的路人丙把阿格列汀評(píng)為過(guò)去十年最不幸的新藥之一,其崎嶇的上市之路堪稱電影“活著”。
Kynamro(通用名:Mipomersen,米泊美生鈉)
Kynamro(通用名:Mipomersen)是繼眼藥Formivisen之后第二個(gè)上市的反義寡核苷酸,用于治療一種罕見的純合家族高血脂癥(HoFH),作為降脂藥物和飲食的輔助藥物,以降低低密度脂蛋白膽固醇、載脂蛋白B、總膽固醇和低密度脂蛋白膽固醇。大多數(shù)包括酶抑制劑、受體激動(dòng)劑或拮抗劑等小分子藥物都是在蛋白水平調(diào)控生物通路。反譯RNA是上個(gè)世紀(jì)末興起的技術(shù),針對(duì)一些不容易在蛋白水平調(diào)控的靶點(diǎn),在其上游RNA水平調(diào)控生物途徑。雖然這個(gè)技術(shù)理論上很吸引人,但實(shí)際上比如穩(wěn)定性較差等困難很多,尤其是做成口服制劑非常難,選擇性也不像原來(lái)預(yù)計(jì)的那么好。之前在1998年上市后又因患者太少而退市的只有治療眼病的Formivisen。后來(lái)出現(xiàn)的siRNA更使反譯RNA黯然無(wú)光,但二者現(xiàn)在都是更廣泛地用于動(dòng)物的靶標(biāo)驗(yàn)證工作,其成藥的難度遠(yuǎn)大于原來(lái)人們的想象。雖然Mipomerson批準(zhǔn)的適應(yīng)癥很小,而且是注射劑,但這也是反譯RNA甚至所有非蛋白水平藥物的一個(gè)里程碑,為以后所謂nondruggable靶點(diǎn)的小分子藥物開發(fā)提供一個(gè)另類選擇。目前在三期臨床的反義RNA項(xiàng)目還有Aganirsen(IRS1抑制劑,Gene Signal)、Belagenpumatucel-L(TGFB2抑制劑,NovaRx)、Drisapersen(DMD調(diào)節(jié)劑,葛蘭素史克)、Custirsen(CLU抑制劑,OncoGenex)、Kappaproct(NFKB1抑制劑,InDex)、Trabedersen(TNFSF13抑制劑,Antisense Pharma)以及Alicaforsen(ICAM1抑制劑,Atlantic Healthcare)。
拒初步統(tǒng)計(jì),從開始反義RNA技術(shù)平臺(tái)的開發(fā)一直到mipomersen的上市,總共花了23年的時(shí)間和30億美元的投資,這個(gè)數(shù)字看起來(lái)很大,實(shí)際上還遠(yuǎn)遠(yuǎn)小于開發(fā)單克隆抗體300億美元的總投資,以及30年的時(shí)間。希望在不久的將來(lái)三代反義RNA將帶來(lái)更大的商業(yè)成功。
Pomalyst(通用名:pomalidomide,泊利度胺)
Pomalyst(通用名:pomalidomide)由美國(guó)塞爾基因(Celgene)開發(fā),是沙利度胺(thalidomide)的衍生物,通過(guò)調(diào)節(jié)T細(xì)胞并抑制其增值,發(fā)揮免疫調(diào)節(jié)作用。美國(guó)FDA在2013年2月8日批準(zhǔn)Pomalyst作為孤兒藥用于治療之前至少接受兩種藥物治療(包括來(lái)那度胺和硼替佐米)60天內(nèi)無(wú)應(yīng)答并有進(jìn)展的多發(fā)性骨髓瘤(MM)。一項(xiàng)Ⅲ期頭對(duì)頭的臨床研究顯示,對(duì)于以上所述難治性多發(fā)性骨髓瘤患者,包括那些接受了高強(qiáng)度預(yù)治療的患者,與大劑量地塞米松相比,免疫調(diào)節(jié)藥物pomalidomide聯(lián)合小劑量地塞米松可顯著延長(zhǎng)生存期。
Kadecyla(通用名:Ado-trastuzumab emtansine,T-DM1)
Kadecyla是美國(guó)FDA批準(zhǔn)的,治療固體腫瘤的第一個(gè)抗體藥物偶聯(lián)物(ADC)。根據(jù)2012年11月發(fā)表在新英格蘭醫(yī)學(xué)雜志上的EMILIA臨床實(shí)驗(yàn)結(jié)果,kadcyla治療組的客觀應(yīng)答率為43.6%,顯著高于卡培他濱/拉帕替尼對(duì)照組的30.8%(P<0.001)。除此之外,kadcyla組的所有二級(jí)實(shí)驗(yàn)終點(diǎn)都優(yōu)于對(duì)照組。而且,3-4級(jí)不良事件的發(fā)生率也由卡培他濱/拉帕替尼組的57%降至Kadcyla組的41%。相信在不久的將來(lái),kadcyla將成為HER2陽(yáng)性乳腺癌的一線標(biāo)準(zhǔn)療法。Kadcyla由美國(guó)ImmunoGen制藥公司研制,和羅氏屬下的基因泰克公司聯(lián)合開發(fā)。Kadcyla采用ImmunoGen的TAP專利技術(shù)把高活性的有絲分裂抑制劑DM1(一種美登素衍生物)用一個(gè)穩(wěn)定的硫醚健接頭連接到羅氏公司的曲拓珠單抗上。因?yàn)榍字閱慰箤?duì)HER2有較高的親和力,kadcyla能有效地靶向結(jié)合表達(dá)HER2的乳腺癌細(xì)胞,而后內(nèi)化并釋放細(xì)胞毒DM1。Kadcyla把抗乳腺癌藥曲拓珠單抗和美登素衍生物DM1完美地結(jié)合到一起,充分利用了前者靶向、選擇性強(qiáng),后者活性高,而又消除了前者療效低和后者副作用大等缺點(diǎn)。
Osphena(通用名:Ospemifene)
Osphena(通用名:Ospemifene)是到目前為止FDA唯一批準(zhǔn)的口服或陰道外用雌激素代用品,用于治療因絕經(jīng)而引起的性交疼痛。Osphena是一種非甾體的,組織選擇性的雌激素激動(dòng)劑或拮抗劑,也就是說(shuō)對(duì)一部分組織的受體起拮抗作用而又能激活另一些組織的雌激素受體。性交疼痛與絕經(jīng)期雌激素水平下降有關(guān)。雌激素減少能夠使陰道組織變薄、干燥和更加脆弱,導(dǎo)致性交時(shí)疼痛。美國(guó)FDA對(duì)Osphena療效和安全性的評(píng)價(jià)主要基于三個(gè),總計(jì)有1889名外陰和陰道萎縮的癥狀的絕經(jīng)后婦女參加的臨床實(shí)驗(yàn):經(jīng)過(guò)12周的治療,使用Osphena不僅顯著減輕絕經(jīng)婦女的性交疼痛,而且明顯改善了包括表皮細(xì)胞、副基底層細(xì)胞以及陰道的pH值等因絕經(jīng)引起的陰道物理變化。鹽野義制藥公司在2010年從QuatRx制藥公司收購(gòu)了Osphena的全球銷售權(quán)。
Lymphoseek注射液(通用名:Technetium Tc-99m tilmanocept)
Lymphoseek注射液(通用名:Technetium Tc-99m tilmanocept)是一種放射性診斷顯影劑,用于患有乳腺癌或黑色素瘤且正在接受腫瘤引流區(qū)域淋巴結(jié)手術(shù)治療患者的淋巴結(jié)定位。淋巴結(jié)過(guò)濾流向身體組織的淋巴液。淋巴液可能含癌細(xì)胞,尤其是引流區(qū)域的淋巴液含有腫瘤細(xì)胞的風(fēng)險(xiǎn)更高。通過(guò)手術(shù)清掃及探查引流腫瘤部位淋巴液的淋巴結(jié),醫(yī)生或可判斷癌癥是否擴(kuò)散。Lymphoseek是繼硫膠體(sulfur colloid)和異硫藍(lán)(isosulfan blue)之后30多年來(lái)首個(gè)獲準(zhǔn)用于淋巴結(jié)定位的新藥。在一項(xiàng)頭對(duì)頭比較Lymphoseek和硫膠體或異硫藍(lán)的臨床實(shí)驗(yàn)中,Lymphoseek在乳腺癌定位淋巴結(jié)及鑒定每位患者淋巴結(jié)數(shù)量等關(guān)鍵指標(biāo)上,都具有明顯優(yōu)勢(shì)。Lymphoseek由只有26年歷史和四十余名員工的Navidea生物制藥公司研發(fā)。該公司雖小,但是專注于醫(yī)學(xué)成像和成像相關(guān)平臺(tái)技術(shù),Lymphoseek是FDA批準(zhǔn)的該公司的第一個(gè)新藥。
Dotarem(Gadoterate meglumine,釓特酸葡甲胺)
Dotarem是一種含釓造影劑,用于成人與大于2歲兒科患者的腦部(顱內(nèi))、脊柱及相關(guān)組織核磁共振成像,以檢測(cè)和顯現(xiàn)血腦屏障受破壞和(或)異常血管分布的區(qū)域。Dotarem注射液的有效成分釓特酸葡甲胺是一種順磁分子,能在磁場(chǎng)中產(chǎn)生磁矩,提高鄰近水質(zhì)子的弛豫率,從而增加信號(hào)強(qiáng)度。Dotarem注射液是繼Magnevist、Prohance、Omniscan、Optimark、Multihance、Gadavist之后美國(guó)FDA批準(zhǔn)用于中樞神經(jīng)系統(tǒng)的核磁共振成像的第7個(gè)含釓造影劑。
Tecfidera(通用名:富馬酸二甲酯)
雖然確切的分子機(jī)制還不是很清楚,甚至很難想象這么簡(jiǎn)單的分子結(jié)構(gòu)能起多大作用,但有證據(jù)表明Tecfidera能夠抑制核轉(zhuǎn)錄因子-κB(NF-κB)的活性,激活體內(nèi)已知的具有防止神經(jīng)細(xì)胞損傷和出現(xiàn)炎癥的Nrf2-ARE 抗氧化信號(hào)通道,抵抗活性氧對(duì)細(xì)胞的損害。在一項(xiàng)為期兩年的安慰劑對(duì)照研究試驗(yàn)中,Tecfidera明顯降低多發(fā)性硬化癥復(fù)發(fā)患者的比例(49%),使年化復(fù)發(fā)率降低53%,使12周明確殘疾進(jìn)展減少38%。在今年3月27日,Tecfidera已被美國(guó)FDA批準(zhǔn),成為復(fù)發(fā)型多發(fā)性硬化癥(MS)的一線口服治療藥物,也是超過(guò)100億美元多發(fā)性硬化癥醫(yī)藥市場(chǎng)諾華的芬戈莫德以及賽諾菲的特立氟胺的強(qiáng)勁競(jìng)爭(zhēng)對(duì)手。
Invokana(通用名:canagliflozin)
強(qiáng)生旗下Janssen的Invokana(通用名:canagliflozin)是在美國(guó)批準(zhǔn)的第一個(gè)鈉葡萄糖協(xié)同轉(zhuǎn)運(yùn)蛋白2(SGLT2)抑制劑,用于治療II型糖尿病。該藥最初由日本三菱旗下的田邊三菱制藥(Mitsubishi Tanabe Pharma)研發(fā),后轉(zhuǎn)讓給Janssen公司。與傳統(tǒng)糖尿病治療藥物的補(bǔ)充和誘導(dǎo)胰島素分泌、改善胰島素抵抗、促進(jìn)葡萄糖利用等機(jī)制不同,SGLT2抑制劑通過(guò)抑制葡萄糖在腎臟近曲小管的重吸收,從尿中排出體內(nèi)多余的葡萄糖。結(jié)構(gòu)上大部分SGLT2的抑制劑,包括去年11月在歐共體上市的Forxiga(通用名:dapagliflozin,百時(shí)美施貴寶/阿斯利康)和empagliflozin(BI/禮來(lái)),是糖類的C-芳基、O-芳基、S-糖苷以及N-糖苷的衍生物,因?yàn)榱己玫难强刂坪蜏p肥效果導(dǎo)致SGLT2抑制劑處于研發(fā)熱點(diǎn)。盡管如此,很多內(nèi)分泌學(xué)家對(duì)SGLT2抑制劑的廣泛使用還持保留態(tài)度,在更多的數(shù)據(jù)證明其藥效和安全性之前,該類藥物在很大程度上只能是繼胰島素、DPP4抑制劑等之后充當(dāng)三線糖尿病用藥。SGLT2抑制劑的優(yōu)勢(shì)和缺點(diǎn)并存,進(jìn)一步的臨床研究以衡量這類藥物的減肥、降血壓等優(yōu)勢(shì),相比增加外陰和尿道感染、脫水、高鉀血癥以及輕微的致癌等風(fēng)險(xiǎn)是SGLT2抑制劑商業(yè)成功的關(guān)鍵。Invokana在2013年的銷售額估計(jì)7千萬(wàn)美元,至2018年達(dá)到其8億美元的銷售峰值。
Breo Ellipta(通用名:fluticasone furoate/vilanterol triflenatate,糠酸氟替卡松/維蘭特羅吸入性粉劑)
今年5月10日,美國(guó)FDA 審批通過(guò)葛蘭素史克的慢性阻塞性肺病藥物Breo Ellipta。該藥物為糠酸氟替卡松和維蘭特羅的吸入型復(fù)方藥物粉末,可每日吸入一次。Breo Ellipta中的糠酸氟替卡松是一種吸入型糖皮質(zhì)激素,維蘭特羅是一種長(zhǎng)效β2腎上腺素受體激動(dòng)劑。該藥物的安全性和有效性通過(guò)一項(xiàng)7700名慢性阻塞性肺病患者參與的臨床試驗(yàn)進(jìn)行了評(píng)價(jià)。用藥組患者相比安慰劑組患者其肺部功能得到了改善,疾病發(fā)作次數(shù)減少。Breo Ellipta在獲批時(shí)其標(biāo)簽內(nèi)容中有一項(xiàng)黑框警告,提示長(zhǎng)效β2腎上腺素受體激動(dòng)劑能增加哮喘有關(guān)的死亡風(fēng)險(xiǎn)。Breo Ellipta用藥患者報(bào)道的最常見副作用有鼻腔炎癥(鼻咽炎)、上呼吸道感染、頭痛及口腔念珠菌病(鵝口瘡)。
Xofigo(Radium Ra-223 dichloride,二氯化鐳)
Xofigo的有效成分是二氯化鐳223(鐳223),可發(fā)射α粒子,對(duì)骨轉(zhuǎn)移癌癥具有抗癌作用。今年5月15日,美國(guó)FDA通過(guò)優(yōu)先評(píng)審?fù)ǖ琅鷾?zhǔn)了拜耳公司的Xofigo(二氯化鐳)注射劑,用于治療晚期前列腺癌。批準(zhǔn)Xofigo是依據(jù)對(duì)809名已擴(kuò)散到骨頭但未擴(kuò)散到其他器官的男性雄激素抵抗性前列腺癌患者進(jìn)行的一個(gè)單一臨床試驗(yàn)。接受Xofigo治療的男性患者的中位生存期為14個(gè)月,相比安慰劑治療組延長(zhǎng)了3個(gè)月。
Tafinlar(通用名:Dabrafenib)和Mekinist(通用名:Trametinib)
葛蘭素史克的Tafinlar(Dabrafenib)和Mekinist(Trametinib)在今年5月29日同時(shí)得到美國(guó)FDA的批準(zhǔn),用于治療轉(zhuǎn)移性或不能行手術(shù)治療的黑色素瘤病人。盡管Tafinlar和Mekinist都是治療黑色素瘤的新藥,且都適用于治療瘤組織內(nèi)BRAF V600E基因突變的患者,但作用機(jī)理卻稍有區(qū)別。Dabrafenib為BRAF抑制劑,和首個(gè)上市的BRAF抑制劑威羅菲尼(Zelboraf,羅氏公司)同屬于一類藥物。而Mekinist是細(xì)胞外信號(hào)調(diào)節(jié)激酶(MEK)抑制劑,能同時(shí)可逆地抑制MEK1和MEK2,調(diào)節(jié)MAPK/ERK信號(hào)通路。單藥使用時(shí),Trametinib能使BRAF變異的晚期黑色素瘤患者的無(wú)進(jìn)展生存期和標(biāo)準(zhǔn)療法相比延長(zhǎng)55%。當(dāng)上述兩種皮膚癌藥物聯(lián)合使用時(shí),無(wú)進(jìn)展生存期的中位數(shù)能從dabrafenib單獨(dú)用藥的5.8個(gè)月延長(zhǎng)至9.4個(gè)月。尤其令人驚訝的是,這兩個(gè)藥聯(lián)合使用時(shí)還能降低單獨(dú)用藥時(shí)的副作用。十幾年以來(lái)MEK抑制劑的開發(fā)進(jìn)展緩慢,選擇性、生物利用度以及毒副作用一直是開發(fā)MEK抑制劑的主要障礙。Trametinib的上市是葛蘭素史克藥物化學(xué)家十幾年努力的回報(bào),也是MEK抑制劑終于走向臨床的開始,尤其是和其它MAPK信號(hào)通路內(nèi)部或外部抗腫瘤制劑的聯(lián)合用藥更具市場(chǎng)開發(fā)潛力。
部分上市新藥的化學(xué)結(jié)構(gòu)
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。
★更多深度解析訪問(wèn)《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源