要聞點(diǎn)評(píng)2013-8-31:RNA干擾治療轉(zhuǎn)甲狀腺素蛋白淀粉樣變性(transthyretin amyloidosis)
作者:呂順
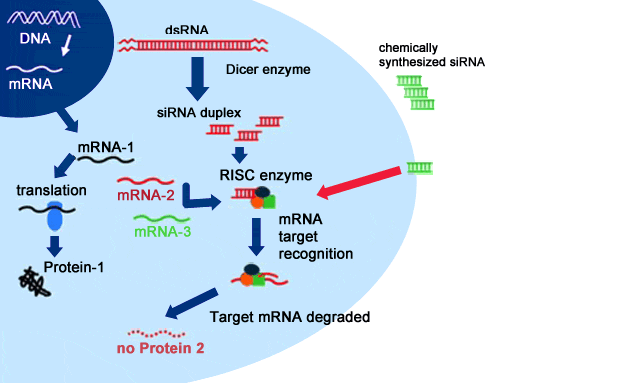
【圖示】通過外源性導(dǎo)入、轉(zhuǎn)基因、病毒感染等途徑引入的雙鏈RNA(dsRNA)被細(xì)胞胞質(zhì)中的核酸內(nèi)切酶Dicer在ATP輔助下被切割成長約21 ~23 bp 具有特定結(jié)構(gòu)由正反義鏈組成的雙鏈小分子干擾RNA( small interfering RNA, siRNA)。 小片段的siRNA 的5憶端被內(nèi)源性激酶快速磷酸化后,其雙鏈被依賴ATP 的RNA 解旋酶解開,釋放出正、反義單鏈。反義siRNA 再與體內(nèi)包括內(nèi)切酶、外切酶、解旋酶等酶結(jié)合,形成RNA 誘導(dǎo)的沉默復(fù)合物。反義RNA 單鏈引導(dǎo)RISC 遵循堿基互補(bǔ)原則尋找互補(bǔ)的mRNA, 在核酸內(nèi)切酶的作用下降解mRNA。
【新聞事件】:《新英格蘭醫(yī)學(xué)雜志》8月29日?qǐng)?bào)道,以de Santo Antonio 醫(yī)院神經(jīng)學(xué)家 Teresa Coelho領(lǐng)導(dǎo)的一項(xiàng)新研究證實(shí),采用RNA干擾療法可以顯著且安全地降低一種罕見肝病致病蛋白的水平。這種叫做轉(zhuǎn)甲狀腺素蛋白淀粉樣變性(transthyretin amyloidosis)的致命遺傳疾病是由于肝細(xì)胞泵出過量轉(zhuǎn)甲狀腺素蛋白(transthyretin)引起。通常情況下,轉(zhuǎn)甲狀腺素蛋白參與體內(nèi)甲狀腺素的運(yùn)輸和維生素A的代謝,但額外的蛋白質(zhì)會(huì)在神經(jīng)、心臟和身體其他部位發(fā)生累積。盡管肝移植能夠延長某些患者的生命,這一疾病仍然無法治愈。研究人員給24名轉(zhuǎn)甲狀腺素蛋白淀粉樣變性患者注入了一種 特定的siRNA ,這種 siRNA 可以抑制細(xì)胞生成轉(zhuǎn)甲狀腺素蛋白。在轉(zhuǎn)甲狀腺素蛋白淀粉樣變性患者組,采用這種siRNA 治療7天后將轉(zhuǎn)甲狀腺素蛋白的水平降低了38%。而把同一種siRNA制成脂質(zhì)納米顆粒能使轉(zhuǎn)甲狀腺素蛋白的水平降低 87%。雖然研究人員還不能確定 siRNA 療法是否減慢了疾病的進(jìn)程, 但這確實(shí)導(dǎo)致了轉(zhuǎn)甲狀腺素蛋白的顯著減少。他們將在一項(xiàng)長達(dá)15個(gè)月,在美國、歐洲和南美開展的隨訪研究中對(duì)此進(jìn)行檢測(cè)。
【相關(guān)事實(shí)】:
? RNA干擾(RNA interference,縮寫為RNAi),也稱為轉(zhuǎn)錄后基因沉默(post-transcriptional gene silencing,PTGS)是通過雙鏈RNA阻礙特定基因的翻譯或轉(zhuǎn)錄的一種基因沉默現(xiàn)象。當(dāng)細(xì)胞中導(dǎo)入與內(nèi)源性mRNA編碼區(qū)同源的雙鏈RNA時(shí),該mRNA發(fā)生降解而導(dǎo)致基因表達(dá)沉默。
? RNAi 是抵御轉(zhuǎn)基因或外來病毒侵犯的防御機(jī)制,是真核生物一種高度保守并具有特異序列的RNA 降解系統(tǒng)。
? 和mRNA不同,siRNA不參與動(dòng)物體的正常生長和發(fā)育,只有在病毒或其它dsRNA誘導(dǎo)情況下才產(chǎn)生并起作用。是mRNA的完善和補(bǔ)充。
【藥源解析】:RNAi技術(shù)已經(jīng)在標(biāo)靶的發(fā)現(xiàn)和確認(rèn)領(lǐng)域得到廣泛的應(yīng)用。生物制藥公司通常利用RNAi文庫感染,然后通過觀察細(xì)胞的表型變化來發(fā)現(xiàn)具有功能的基因。比如通過RNAi文庫介導(dǎo)的腫瘤細(xì)胞生長來發(fā)現(xiàn)能抑制腫瘤的基因,一旦所發(fā)現(xiàn)的基因?qū)儆诳沙伤帲╠ruggable)的靶標(biāo),將繼續(xù)在細(xì)胞或動(dòng)物水平認(rèn)證。與反義寡核苷酸、核酶或脫氧核酶等其他基因敲除技術(shù)相比,RNA干擾技術(shù)具有高特異性、高效性、高穩(wěn)定性、可傳播性和可遺傳性的分子生物學(xué)特征,siRNA本身也被應(yīng)用于包括腫瘤、帕金森、病毒感染、類風(fēng)濕、內(nèi)分泌等疾病的治療。
【未來影響】:相信很多人都被有機(jī)化學(xué)老師忽悠過,就是如果我們有足夠多的時(shí)間,可以人工合成自然界任何存在或能想象到的有機(jī)分子。實(shí)際上完全不是這回事兒,尤其在新藥研發(fā)領(lǐng)域,不僅一個(gè)項(xiàng)目不可能給我們太多的時(shí)間,更有很多實(shí)際的技術(shù)挑戰(zhàn)。另外,除了缺少優(yōu)質(zhì)靶點(diǎn),按照我們目前的藥物化學(xué)、藥理毒理、臨床開發(fā)技術(shù)水平也不是總能開發(fā)任何靶點(diǎn)的新藥。還有很多諸如活性、選擇性、過膜性、以及無可解釋的毒性等技術(shù)難關(guān),經(jīng)常在短時(shí)間內(nèi)找不到具有成藥性的分子。一些蛋白-蛋白相互作用的靶點(diǎn)也可列入 “nondruggable”靶點(diǎn)之列。幸運(yùn)的是,現(xiàn)代生物學(xué)的飛速發(fā)展帶給了我們更多的選擇,比如有了好靶點(diǎn),即使找不到可逆配體,也可能找到共價(jià)不可逆配體,找不到小分子藥物還可以設(shè)法尋找生物大分子。無法在蛋白水平調(diào)控還可能在RNA,基因水平上調(diào)控。筆者以為,就目前研究水平而言,RNA干擾作為一種新療法主要針對(duì)那些一時(shí)找不到合適druggable藥物的靶點(diǎn)。
實(shí)際上, RNAi療法在多個(gè)疾病的研究領(lǐng)域都有了長足的進(jìn)步。比如在抗腫瘤領(lǐng)域,通過構(gòu)建特異性地靶向UHRF1的雙鏈RNA,并轉(zhuǎn)染乳腺癌細(xì)胞MCF,結(jié)果明顯地抑制UHRF1基因的表達(dá),誘導(dǎo)了癌細(xì)胞的凋亡【1】,同時(shí)增強(qiáng)了癌細(xì)胞對(duì)鉑類化療藥物的敏感性,而對(duì)正常癌細(xì)胞卻沒有影響。采用RNA干擾技術(shù)能有效地逆轉(zhuǎn)MDRl基因介導(dǎo)的胰腺癌和胃癌耐藥細(xì)胞株的多藥耐藥。在眼科領(lǐng)域,RNAi 技術(shù)能夠有效地阻止視網(wǎng)膜新生血管的形成,抑制增生性玻璃體視網(wǎng)膜病變的發(fā)生或進(jìn)展,誘導(dǎo)視網(wǎng)膜母細(xì)胞瘤細(xì)胞的凋亡【2】。盡管RNAi 已經(jīng)成為阻斷或抑制基因表達(dá)的首選工具,但因?yàn)閐sRNA 分解的siRNA 與細(xì)胞內(nèi)其他非靶正常基因存在部分序列同源,能導(dǎo)致脫靶效應(yīng)等非特異性反應(yīng)。另外,雙鏈RNA還能激活天然免疫系統(tǒng),誘導(dǎo)IFN2、TNF2、IL26 等炎癥因子,抑制細(xì)胞的生長并產(chǎn)生毒副作用。RNA還有穩(wěn)定性差、吸收效率低等成藥缺點(diǎn),致使RNA干擾療法遲遲未能進(jìn)入臨床。但是,隨著藥物輸送技術(shù)的進(jìn)展,RNA干擾療法相信在不久的將來會(huì)有巨大突破。
雖然RNA干擾技術(shù)在臨床應(yīng)用方面進(jìn)展相對(duì)緩慢,但作為全基因組致病基因的篩選已經(jīng)有重大進(jìn)展。來自洛克菲勒大學(xué)的研究人員最近報(bào)道,他們構(gòu)建了一種匯集了多個(gè)小發(fā)夾 RNA的組合RNA干擾技術(shù),他們把這些短 RNA 片段通過病毒導(dǎo)入妊娠小鼠胚胎,這些RNA片段能夠終止來自特異基因的信息,阻止基因合成蛋白質(zhì)。他們又對(duì)每個(gè)小發(fā)夾 RNAs進(jìn)行了定量,利用它來衡量這些小發(fā)夾 RNA對(duì)于生長過程的相對(duì)重要影響。這使研究人員能夠用較少的小鼠來篩查更多的基因。該研究小組只用 100 窩的小鼠篩查了超過 1.6 萬個(gè)基因,確定了大約 200 個(gè)對(duì)于皮膚惡性生長特別重要的基因。
參考文獻(xiàn):
【1】胡小輝,李建文“RNA 干擾技術(shù)在乳腺癌治療中的研究進(jìn)展”。中華乳腺病雜志 2013 年第7 卷52-56頁。
【2】李光輝,彭燕。“RNA 干擾技術(shù)在視網(wǎng)膜疾病治療中的研究進(jìn)展”Int. Eye Sci. 2013,5,901-904.
★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源