PARP抑制劑研究回暖,再次成為抗癌領(lǐng)域的“潛力股”
作者:呂順
聚腺苷二磷酸核糖聚合酶(PARP)是一類真核細(xì)胞中催化聚核糖化的細(xì)胞核酶,對(duì)修復(fù)DNA的損傷并維持基因組的完整性起著關(guān)鍵作用。當(dāng)受到輻射、氧化或化療藥物的作用時(shí),DNA的雙鏈或單鏈結(jié)構(gòu)經(jīng)常受損。PARP-1能通過其鋅指結(jié)構(gòu)迅速檢測(cè)到,并和DNA損傷的缺口結(jié)合,導(dǎo)致PARP的激活,催化以β-NAD+為底物的ADP-核糖聚合,合成聚腺苷二磷酸核糖(PAR),并引發(fā)染色體松弛,促使DNA修復(fù)酶、XRCC1以及DNA連接酶III等修復(fù)因子向DNA損傷部位的遷移和結(jié)合,完成對(duì)損傷DNA的修復(fù)。
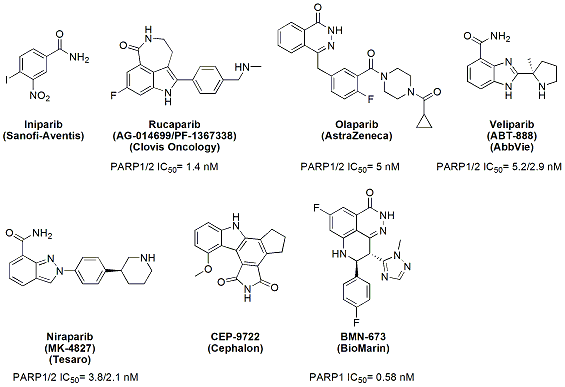
PARP-1介導(dǎo)的DNA修復(fù)起著多重分子生物學(xué)效應(yīng)。一方面PARP是導(dǎo)致化療或放療耐藥的重要因素之一。另一方面,按照合成致死理論,兩個(gè)基因之間若存在合成致死作用,當(dāng)其中任何一個(gè)基因單獨(dú)受到抑制或發(fā)生突變時(shí),細(xì)胞的生存不受影響,但同時(shí)抑制兩個(gè)基因?qū)?dǎo)致細(xì)胞凋亡。所以,PARP抑制劑不僅是化療、放療的增敏劑,單獨(dú)使用時(shí)對(duì)于那些包括BRCA-1/2基因突變或HR缺陷的腫瘤也有抑制作用。體外實(shí)驗(yàn)表明,抑癌基因BRCA-1/2缺陷或突變的乳腺癌和卵巢癌細(xì)胞,對(duì)PARP-1抑制劑的敏感性是正常細(xì)胞的1000倍。事實(shí)上,在兩千年初期,PARP一度成為抗腫瘤領(lǐng)域最重要的靶點(diǎn)之一。至少有7個(gè)小分子化合物進(jìn)入不同階段的臨床實(shí)驗(yàn),其中包括Iniparib、Rucaparib,、Olaparib、Veliparib、Niraparib、 CEP-9722和BMN-673(見下圖)。
在2009年,當(dāng)賽諾菲以5億美元將Iniparib連同BiPar Sciences一塊收購(gòu)時(shí),PARP抑制劑的研究走向頂峰,甚至一些機(jī)構(gòu)還把PARP抑制劑評(píng)為抗腫瘤領(lǐng)域最重大的突破之一。Iniparib在多個(gè)二期臨床治療三陰乳腺癌顯示良好療效。賽諾菲的這款抗癌藥也被視為潛在的重磅炸彈級(jí)產(chǎn)品。然而在隨后的一年里峰回路轉(zhuǎn),Iniparib的喜人結(jié)果并沒有在更大的三期臨床實(shí)驗(yàn)里得到證實(shí),而且Iniparib在包括卵巢癌、非小細(xì)胞肺癌中的實(shí)驗(yàn)結(jié)果均沒有達(dá)到預(yù)計(jì)實(shí)驗(yàn)終點(diǎn)。因?yàn)镮niparib不是真正意義上的PARP抑制劑,在體內(nèi)迅速代謝并且能和多種蛋白結(jié)合,Iniparib的開發(fā)失敗還不意味著PARP抑制劑的全面失利。2011年12月,阿斯利康決定終止Olaparib的III期臨床開發(fā)。制藥巨頭輝瑞和默克也紛紛把旗下Rucaparib和Niraparib轉(zhuǎn)讓,真正標(biāo)志PARP抑制劑的研究走向低谷。
時(shí)隔一年再次峰回路轉(zhuǎn),今年初在芝加哥舉行的美國(guó)臨床腫瘤學(xué)會(huì)年會(huì)上報(bào)道,多個(gè)PARP抑制劑顯示積極療效,其中就包括Tesaro公司從默克收購(gòu)的Niraparib、Clovis Oncology公司從輝瑞收購(gòu)的Rucaparib、以及BioMarin公司從Lead Pharmaceutical收購(gòu)的BMN-673。阿斯利康9月4日宣布,重新啟動(dòng)旗下Olaparib包括兩項(xiàng)研究的三期臨床,評(píng)價(jià)其作為單藥治療攜帶BRCA突變,并且對(duì)鉑類化療藥物有響應(yīng)的卵巢癌患者的療效。除此之外,阿斯利康也準(zhǔn)備評(píng)價(jià)Olaparib用于包括乳腺癌等其它與BRCA突變相關(guān)腫瘤的臨床開發(fā),并將觀察這款藥物與其它抗癌藥聯(lián)合使用時(shí)治療前列腺癌和胃癌的效果。
阿斯利康最初擱置Olaparib的開發(fā)有多重因素,其中一個(gè)主要原因是一項(xiàng)卵巢癌二期臨床沒有達(dá)到預(yù)期實(shí)驗(yàn)終點(diǎn)。患者一天必需服用8粒Olaparib膠囊的劑量也對(duì)阿斯利康這個(gè)決定有較大影響。當(dāng)時(shí)的結(jié)果顯示這款藥物使卵巢癌患者的無進(jìn)展生存期提高大約三個(gè)月。阿斯利康經(jīng)過篩選包括BRCA基因突變等亞組發(fā)現(xiàn),這個(gè)二期臨床對(duì)BRCA基因突變患者的無進(jìn)展生存期提高了8個(gè)多月,遠(yuǎn)高于將項(xiàng)目向前推進(jìn)的最低限度值。而且阿斯利康也成功的開發(fā)了一種奧拉帕尼新劑型,使患者每天服用的藥片減少一半。Olaparib的這兩項(xiàng)試驗(yàn)均為隨機(jī)、雙盲、安慰劑對(duì)照研究,患者將通過Myriad Genetics公司開發(fā)的一種BRCA伴隨診斷試劑進(jìn)行篩選,主要終點(diǎn)均為疾病無進(jìn)展生存期(PFS)。
除了以上這些積極結(jié)果以外,PARP抑制劑的研究熱潮更是全方位的:一個(gè)最明顯的征兆就是最近兩年再次涌現(xiàn)大量和PARP抑制劑相關(guān)的專利。伴隨診斷試劑盒的使用可以觀察PARP抑制劑在多重亞組患者中的療效。考慮到傳統(tǒng)抑制劑都是靶向β-NAD+催化活性位點(diǎn),然而這種方法存在局限性,因?yàn)樵谝恍┢渌膱?zhí)行重要細(xì)胞功能的PARP樣蛋白中也具有相似的催化位點(diǎn),因而增高了脫靶效應(yīng)的可能性。以托馬斯杰斐遜大學(xué)Kimmel癌癥中心John M. Pascal教授領(lǐng)導(dǎo)的課題組研究了包括“鋅指”區(qū)域等抑制PARP活性的新靶位點(diǎn),并有重大突破。雅培集團(tuán)的研究人員發(fā)現(xiàn)旗下PARP抑制劑Velaparib能有效地預(yù)防化療引起的周圍神經(jīng)病變(CIPN),有望治療化療引起的神經(jīng)性疼痛這一化療產(chǎn)生的主要不良作用。其它包括抗體藥物偶聯(lián)物等新型技術(shù)的應(yīng)用也能顯著提高這類抗癌藥對(duì)腫瘤組織的靶向性。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源