要聞點(diǎn)評(píng)2013年11月3日:默克全口服MK-5172/MK-8742組合中期結(jié)果出爐,抗丙肝市場(chǎng)競(jìng)爭(zhēng)日趨激烈
作者:呂順
【新聞事件】據(jù)美國商業(yè)電訊消息,默沙東(Merck & Co)今天在第64屆美國肝病研究協(xié)會(huì)年會(huì)(Washington D.C,Nov 1-5)上發(fā)布其全口服抗丙肝實(shí)驗(yàn)藥MK-5172/MK8742組合的IIB期臨床實(shí)驗(yàn)結(jié)果(C-WORTHY實(shí)驗(yàn)),用于治療HCV基因1型初治患者、治療失敗的患者、以及其他重要的如肝硬化患者和HCV/HIV合并感染等HCV亞群。該二期實(shí)驗(yàn)還在進(jìn)行,中期數(shù)據(jù)顯示配服MK-5172/MK-8742連續(xù)12周后三個(gè)實(shí)驗(yàn)組中的兩個(gè)到目前為止全部達(dá)到持續(xù)病毒學(xué)應(yīng)答(SVR12)。
默克實(shí)驗(yàn)藥MK-5172/MK-8742組合是一種全口服抗丙肝方案。前者是NS3/4A蛋白酶抑制劑,后者是HCV NS5A復(fù)制復(fù)合物抑制劑。這個(gè)C-WORTHY實(shí)驗(yàn)共注冊(cè)65位丙肝患者,其中有效患者數(shù)為58位,分為三個(gè)治療組:MK-5172(100毫克)/MK-8742(20毫克)和利巴韋林三聯(lián)用藥組由22位患者組成,MK-5172(100毫克)/MK-8742(50毫克)和利巴韋林三聯(lián)用藥組包括24位患者,MK-5172(100毫克)/MK-8742(50毫克)聯(lián)合用藥組只有12為患者。其中三聯(lián)的低劑量用藥組和MK-5172/MK-8742聯(lián)合組12周后都取得百分之百的持續(xù)病毒學(xué)應(yīng)答。而MK-5172(100毫克)/MK-8742(50毫克)和利巴韋林三聯(lián)用藥組有一位患者在隨訪的第4周和12周經(jīng)歷復(fù)發(fā)。檢測(cè)到HCV RNA。該組合耐受性良好,常見不良反應(yīng)包括疲勞(26%)、頭痛( 22%)、惡心(18%)、腹瀉(12% )、頭暈(11%)和皮疹(11%)。所有患者都未有觀察到三級(jí)或四級(jí)不良事件,而且也未有因耐受性引起的停藥。根據(jù)該積極的初步實(shí)驗(yàn)結(jié)果,默克決定進(jìn)一步擴(kuò)展這個(gè)二期臨床,總注冊(cè)患者數(shù)將達(dá)400人。
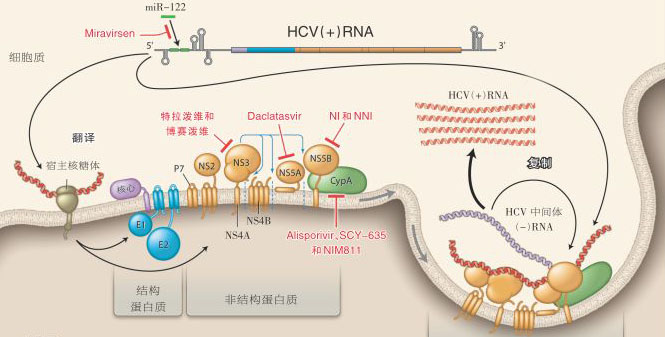
【藥源解析】全球可能有高達(dá)1億7千萬人攜帶丙肝病毒,而僅美國就有4百萬患者。所以丙型肝炎藥物市場(chǎng)是一個(gè)大餅,估計(jì)到2020年規(guī)模可能達(dá)到250億美元。HCV是一種正鏈RNA病毒,含有六個(gè)基因型。如上圖所示,HCV病毒的結(jié)構(gòu)蛋白由兩種包膜糖蛋白和核心蛋白構(gòu)成,非結(jié)構(gòu)蛋白NS2、NS3、NS4A、NS4B、NS5A和NS5B與病毒RNA形成復(fù)合物,在一個(gè)細(xì)胞質(zhì)膜性結(jié)構(gòu)中啟動(dòng)病毒的復(fù)制。HCV主要感染肝細(xì)胞,并且具有一種神秘的、可以多種方式逃避宿主免疫應(yīng)答反應(yīng)的能力。
慢性丙型肝炎的治療目標(biāo)是清除病毒,從而可限制或防止并發(fā)癥的發(fā)生,成功治療的終點(diǎn)是持續(xù)病毒學(xué)應(yīng)答,定義為已停止治療后的24周時(shí),血清中檢測(cè)不到HCV RNA。到目前為止,抗HCV病毒感染的藥物一部分直接作用于病毒靶點(diǎn),而其它一些藥物的靶點(diǎn)是對(duì)HCV復(fù)制至關(guān)重要的宿主蛋白。而對(duì)于所有丙肝亞型,聚乙二醇干擾素和利巴韋林聯(lián)合應(yīng)用依然是慢性丙型肝炎患者的標(biāo)準(zhǔn)治療。應(yīng)用這一方案,基因2或3型HCV感染患者可獲得70%~80%的持續(xù)病毒學(xué)應(yīng)答率,其他任何基因型的患者可獲得45%~70%的持續(xù)病毒學(xué)應(yīng)答率。
特拉潑維(telaprevir)和博賽潑維(boceprevir)是兩種最早獲批的NS3/4A絲氨酸蛋白酶抑制劑。從而使得HCV基因1型感染的治療有了三聯(lián)療法,即將這兩種蛋白酶抑制劑的其中一種與聚乙二醇干擾素和利巴韋林聯(lián)合應(yīng)用。這兩種三聯(lián)療法方案的應(yīng)答率相似,但在給藥時(shí)機(jī)方面卻差異很大。也未被批準(zhǔn)用于除了基因1型以外的其他基因型HCV感染患者。而且盡管三聯(lián)療法方案比無蛋白酶抑制劑的聚乙二醇干擾素和利巴韋林方案更有效,但它們也有額外的副作用,治療也相當(dāng)復(fù)雜,還有許多藥物相互作用的潛在問題。
10月24日,美國FDA抗病毒專家小組一致投票建議批準(zhǔn)Medivir/強(qiáng)生旗下NS3/4A抑制劑Simeprevir上市。如果FDA遵循該建議,那么Simeprevir將成為美國上市的第三款丙型肝炎蛋白酶抑制劑。這款藥物已于上個(gè)月在日本以Sovriad為商品名獲得上市批準(zhǔn),而日本也是其全球第一個(gè)市場(chǎng)。和其它兩款蛋白酶抑制劑一樣,Simeprevir只適用于HCV 基因1型感染,需要與聚乙二醇干擾素、利巴韋林聯(lián)用。之前開展的三個(gè)III期臨床實(shí)驗(yàn)中,治療組與對(duì)照組的SVR12分別為80%、50%;針對(duì)復(fù)發(fā)患者的HPC3007試驗(yàn)中,治療組與對(duì)照組的SVR12率分別為79%、36%。Simeprevir的臨床試驗(yàn)有4例患者死亡,但被認(rèn)定與治療無關(guān),另外有0.4%的患者有嚴(yán)重不良反應(yīng)(1例患者重性抑郁,2例患者有光敏反應(yīng)),這被認(rèn)定與使用simeprevir有關(guān)。
另一種可能更具潛力的抗丙肝靶點(diǎn)是NS5A聚合酶,它在裝配細(xì)胞質(zhì)膜-結(jié)合的復(fù)制復(fù)合物中起重要作用。目前,已經(jīng)開發(fā)出多種包括核苷酸和非核苷酸類似物的NS5B聚合酶抑制劑。核苷酸抑制劑靶向保守核苷酸結(jié)合袋,是鏈聚合的終止劑。而非核苷酸抑制劑與NS5B的其它區(qū)域結(jié)合,是變構(gòu)抑制劑。有近二十種的NS5B抑制劑處于處于不同階段的臨床實(shí)驗(yàn)中,其中吉利德的Sofosbuvir走在最前列,也是首個(gè)實(shí)現(xiàn)純口服的抗丙肝藥物,對(duì)于HCV 的基因2型和3型感染只需與利巴韋林聯(lián)用,F(xiàn)DA專家小組也支持其聯(lián)合聚乙二醇干擾素、利巴韋林用于HCV基因1型和4型感染。
Gilead已經(jīng)開展了四項(xiàng)III期臨床試驗(yàn)評(píng)價(jià)sofosbuvir的療效和安全性。其中,F(xiàn)ission選擇感染2或3型丙肝病毒病人,隨機(jī)接受12周仿核苷酸藥sofosbuvir與利巴韋林聯(lián)合用藥,或24周利巴韋林與聚乙二醇化干擾素聯(lián)合用藥(所謂標(biāo)準(zhǔn)療法)。治療結(jié)束時(shí)兩組病人都達(dá)到了67%的持久性病毒學(xué)應(yīng)答(SVR)。在POSITRON實(shí)驗(yàn)中,sofosbuvir和利巴韋林聯(lián)合用藥組對(duì)于干擾素耐藥,基因2型和3型患者的 SVR12分別為93%、61%,而安慰劑對(duì)照組沒有任何應(yīng)答。在NeutrinoIII期實(shí)驗(yàn)中,基因1型,4,5或6丙型肝炎病毒感染的患者進(jìn)行為期12周的sofosbuvir加利巴韋林與聚乙二醇化干擾素聯(lián)合用藥。治療結(jié)束病人都達(dá)到了90%的持久性病毒學(xué)應(yīng)答(SVR)。而預(yù)期的只用利巴韋林與聚乙二醇化干擾素聯(lián)合用藥的SVR率為60%。Sofosbuvir臨床試驗(yàn)中未發(fā)現(xiàn)嚴(yán)重不良反應(yīng),最常見的副作用包括疲勞、頭痛、昏迷、失眠和貧血。未出現(xiàn)因心臟副作用停藥。吉利德于2013年4月提交了sofosbuvir的新藥申請(qǐng)(NDA),F(xiàn)DA于2013年6月授予sofosbuvir NDA優(yōu)先審查資格。Sofosbuvir NDA所包含的數(shù)據(jù),支持了將sofosbuvir與利巴韋林(RBV)作為一種全口服療法用于基因型2型和3型HCV感染的治療,以及將sofosbuvir與利巴韋林、聚乙二醇干擾素(PEG-IFN)用于基因型1型、4型、6型HCV感染的治療。
盡管波西普韋與特拉普韋均對(duì)丙型肝炎的治療產(chǎn)生了巨大的影響,提高了以干擾素為基礎(chǔ)治療方案的有效性,并快速進(jìn)入市場(chǎng),但必須與干擾素和聯(lián)用。干擾素需要注射而利巴韋林有嚴(yán)重的感冒狀副反應(yīng),加上治療時(shí)間較長(5個(gè)月以上),所以病人負(fù)擔(dān)很重。而目前包括sofosbuvir在內(nèi)的在研全口服、無利巴韋林組合療效更好,使用更方便,副作用遠(yuǎn)小于波西普韋或特拉普韋/干擾素/雷巴威林組合。10月25日,美國FDA抗病毒藥物專家小組公布了投票結(jié)果,支持吉利德的sofosbuvir上市。雖然FDA咨詢委員會(huì)不代表FDA,但也標(biāo)志著Gilead基本完成最后沖刺,如果沒有意外,今年年底會(huì)推向市場(chǎng)。其它蛋白酶抑制劑類藥物包括勃林格殷格翰的Faldaprevir,默沙東的Vaniprevir,百時(shí)美施貴寶的Asunaprevir,以及雅培生命的ABT 450與第一代抗丙肝藥物相比也有優(yōu)越的病毒治愈率和更溫和的副作用。和sofosbuvir相比也只有一步之遙。因?yàn)閟ofosbuvir的療效并未完全達(dá)到業(yè)界的預(yù)期,要保持其領(lǐng)先地位,占領(lǐng)絕大部分的市場(chǎng)份額還需繼續(xù)努力。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。
★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源