
美國FDA批準強生丙肝藥Olysio(simeprevir)上市,市場前景不容樂觀
作者:呂順
【新聞背景】2013年11月22日,美國FDA批準了強生的Olysio(通用名:simeprevir,曾用名:TMC435)上市,用于和聚乙二醇干擾素α和利巴韋林聯(lián)用,治療基因I型的慢性丙型肝炎病毒感染。本品為膠囊制劑,每天口服150毫克一次,用于代償性肝病(患者的肝臟仍能工作),包括肝硬化以及從未接受過治療或以前接受聚乙二醇干擾素α或利巴韋林治療但沒有效果的成人患者。Medivir因此收到強生1千萬歐元的里程金。但是FDA要求強生提供包括種族、是否HIV感染以及其他特定患者群的上市后隨訪結(jié)果。
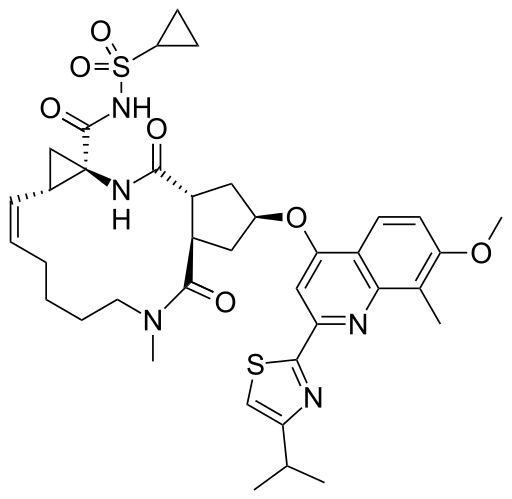
【藥源解析】Simeprevir是由Medivir AB研發(fā)的一種NS3/4A蛋白酶抑制劑,隨后被強生旗下的Janssen愛爾蘭收購。Simeprevir的化學結(jié)構(gòu)如下:
Simeprevir是第三個上市的NS3/4A蛋白酶抑制劑。其它兩個是默克的Victrelis (boceprevir,博賽潑維)和Vertex的Incivek (telaprevir,特拉潑維),分別在2011年獲批上市。和其它兩款蛋白酶抑制劑一樣,Simeprevir只適用于HCV 基因1型感染,需要與聚乙二醇干擾素、利巴韋林聯(lián)用。除了以上批準的和聚乙二醇干擾素α以及利巴韋林聯(lián)用以外,simeprevir還在進行多種臨床實驗,評價包括治療基因IV慢性丙型肝炎病毒以及其它聯(lián)合用藥的療效和安全性。
美國FDA對simeprevir的審批主要基于五個積極的隨機、雙盲、安慰劑對照的,共注冊有兩千余患者的晚期臨床結(jié)果:對于既往未接受治療的HCV 基因I型感染患者,simeprevir和聚乙二醇干擾素α以及利巴韋林組與安慰劑和聚乙二醇干擾素α以及利巴韋林組的12周持續(xù)病毒學應答率(SVR12)分別為80%和50%;對于既往干擾素治療復發(fā)的HCV 基因I型感染患者,simeprevir和聚乙二醇干擾素α以及利巴韋林組與安慰劑和聚乙二醇干擾素α以及利巴韋林組組的SVR12應答率分別為79%和37%。Simeprevir在這些臨床實驗中有4例患者死亡,但被認定與治療無關(guān),另外有0.4%的患者有嚴重不良反應(1例患者重性抑郁,2例患者有光敏反應),這被認定與使用simeprevir有關(guān)。
眾所周知,丙型肝炎是一種病毒性感染,它引起可導致肝功能減退或衰竭的肝臟炎癥。多數(shù)感染丙型肝炎病毒者起初沒有癥狀,直至肝功能損害明顯,這個過程可能長達幾年時間。這些人大多之后變成慢性丙型肝炎,多年后某些患者出現(xiàn)疤痕和肝硬化,還可能導致一系列如出血、黃疸、腹水、感染或肝癌等并發(fā)癥。根據(jù)疾病預防和控制中心統(tǒng)計,大約有320萬美國人感染丙型肝炎病毒。以上三個NS3/4A蛋白酶抑制劑的上市,使得HCV基因1型感染的治療有了三聯(lián)療法,即將這三種蛋白酶抑制劑的其中一種與聚乙二醇干擾素和利巴韋林聯(lián)合應用。這些三聯(lián)療法的應答率和聚乙二醇干擾素以及利巴韋林方案相比有效地提高了患者的持續(xù)病毒學應答率,但它們也有額外的副作用,除此之外治療也相當復雜,還有許多藥物相互作用的潛在問題。而且到目前為止也未被批準用于除了基因1型以外的其他基因型HCV感染患者。盡管如此,本站路人丙已經(jīng)詳細討論過Incivek在2011年5月上市以后,當年第四季度銷售即達到4.5億美元,當年就成為超過10億美元的重磅藥物,是史上銷售最快的新藥。但是好景不長,其下滑的速度也同樣驚人,今年第三季度僅銷售8000萬美元。
因為NS3/4A蛋白酶抑制劑必須與干擾素聯(lián)用,盡管在一定程度上提高了療效,仍然遺留了干擾素的感冒樣副作用和注射給藥給患者帶來的不便。尤其是新型在丙肝病毒的復制機制中起重要作用的NS5B聚合酶抑制劑的開發(fā),給以上三個上市的NS3/4A蛋白酶抑制劑造成了更大的挑戰(zhàn)。到目前為止,已經(jīng)有近二十種的核苷酸和非核苷酸類NS5B抑制劑處于不同階段的臨床實驗中,其中吉利德的Sofosbuvir估計下個月就能上市,也是首個實現(xiàn)純口服的抗丙肝藥物,對于HCV 的基因2型和3型感染只需與利巴韋林聯(lián)用,同時FDA專家小組也支持其聯(lián)合聚乙二醇干擾素、利巴韋林用于HCV基因1型和4型的病毒感染。
正因為包括吉利德的sofosbuvir、雅培生命的三聯(lián)劑、以及默克的MK-5172/MK-8742組合等全口服抗丙肝藥物即將上市,直接導致了Invicek的慘淡銷售。Vertex周四(11月21日)宣布以1.52億美元將Invicek轉(zhuǎn)讓給其銷售伙伴楊森,從2014年起將不再享受任何銷售提成。Incivek成為史上最曇花一現(xiàn)的重磅藥物。由此可見,作為同樣是NS3/4A蛋白酶抑制劑,而且臨床上并未見突出表現(xiàn)的simeprevir的銷售前景不容樂觀,要想在百億美元的抗丙肝市場分得較大份額恐怕有點難。
正如路人丙陳述的那樣,Incivek和以往銷售的快速下降不同,并非由于意外安全性問題或?qū)@狡冢且驗槟壳坝卸鄠€全口服丙肝藥物組合會很快上市。事實上Incivek是首創(chuàng)藥物,在2011,2012年幾乎完勝默克的同類藥物Victrelis。即使這樣也無法保證長時間盈利因為更好的標準療法即將出現(xiàn)。從另一個側(cè)面反映了me-too類新藥研發(fā)不僅要優(yōu)于現(xiàn)有標準療法,也必須面對嶄新靶點的挑戰(zhàn)。尤其是今天的新藥研發(fā)已經(jīng)和過去有所不同,嶄新機理的出現(xiàn)并沒有推動藥品銷售的擴大,而是在原有的份額中分出一杯羹。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源