強效免疫細胞療法CTL019的市場和挑戰(zhàn)
作者:呂順
自體細胞免疫療法先通過采血提取患者體內(nèi)的免疫細胞,再在實驗室進行體外修飾活化,形成能精確地靶向腫瘤細胞的細胞毒T淋巴細胞(CTL),最后再把這些表面修飾過的免疫細胞回輸患者體內(nèi),從而誘發(fā)患者產(chǎn)生大量對腫瘤細胞具備免疫殺傷作用的免疫細胞。自身細胞療法的優(yōu)缺點并存:因為通常分離并輸回體內(nèi)的是一種未分化、未成熟的細胞,其細胞表面的抗原表達水平較低,患者自身的免疫系統(tǒng)對這種未分化細胞的識別能力較弱,避免了象器官移植一樣的免疫排斥反應等嚴重不良反應。但是該療法本身的過程復雜,治療成本高,而且任何失誤都容易造成包括死亡等重大事故。
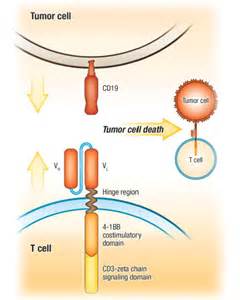
諾華公司的CTL019是一種強效免疫細胞療法。醫(yī)務人員通過采血從患者獲得部分T細胞,然后在實驗室把識別CD19的抗體偶聯(lián)到這些T細胞表面,由此形成帶有能攻擊B細胞表面CD19的嵌合抗原受體(chimeric antigen receptor,CAR)的免疫細胞。CTL019細胞在被輸回患者體內(nèi)能迅速增殖上千倍,并數(shù)月內(nèi)在患者體內(nèi)持續(xù)存在,可能有助于預防患者疾病的復發(fā)。
在早期臨床實驗中CTL019已經(jīng)表現(xiàn)良好的療效。急性淋巴細胞白血病(ALL)是一種最常見的兒童癌癥。雖然經(jīng)過幾十年的努力、探索,目前ALL的治愈率能高達85%以上,但對一些頑固性、抵抗常規(guī)治療的高危險性ALL還束手無策。根據(jù)上個月在美國血液病新奧爾良年會上的報道(CART-19實驗),22例骨髓移植和所有標準療法失敗的ALL患者接受了CTL019免疫細胞療法以后,其中的19位兒童表現(xiàn)完全緩解,占86%。首個接受治療的兒童患者到目前為止,也就是在接受治療后20個月以后依然健康,沒有檢測到血癌細胞的存在。此外,五個接受治療的成人ALL患者也表現(xiàn)完全緩解。
在一個小型成人慢性淋巴細胞性白血病(CLL)患者的實驗中,CTL019免疫療法表現(xiàn)了47%(15名)的應答,其中有近一半(7名)是完全應答。該療法的發(fā)明人之一,賓夕法尼亞大學的Carl June教授說,“CTL019免疫療法是能治療骨髓移植失敗的唯一療法”。今年3月25日的《新英格蘭醫(yī)學雜志》(NEJM)雜志還報道了采用CTL019免疫細胞療法治療兩名患有侵襲性白血病兒童的積極臨床結(jié)果。這兩名患者一位是美國費城的7歲女童艾瑪?懷特海德,她在4歲時被診斷患有白血病,盡管艾瑪接受過兩次化療,但不久后復發(fā),而且任何常規(guī)治療手段都不再對她起作用。在艾瑪生命垂危之際,她的父母和醫(yī)生決定讓女兒接受CTL019治療。在接受了抗CD19的CTL019嵌合抗原受體T細胞治療以后,病情獲得了完全緩解。據(jù)說艾瑪治療后11個月還依然健康,沒有發(fā)現(xiàn)癌癥癥狀。而且和預期的一樣,嵌合抗原受體T細胞的數(shù)量均增長至輸入值的1000倍,并在骨髓中檢測到這種細胞的存在。另一名患者是一個10歲的小女孩,在接受相同的治療后病情也得到了完全緩解。遺憾的是這個小女孩兩個月后再度復發(fā),并且母細胞不再表達CD19。
盡管以上的臨床實驗都是小型的,病例很少。但大部分研究人員都相信CTL019療法的臨床效果。CTL019療法最大的挑戰(zhàn)可能還是其操作太復雜,如果有替代療法,很難說服臨床醫(yī)生采用這個有較大安全隱患的治療方式。CTL019的開發(fā)商諾華集團準備先從急性淋巴細胞白血病著手,而后再開發(fā)市場較大的慢性淋巴細胞白血病適應癥。去年諾華用4千3百萬美元收購了Dendreon公司在西雅圖的免疫細胞治療設施。如果順利,諾華準備在2016年向FDA申報CTL019上市。然而,筆者預計CTL019的商業(yè)成功不會一帆風順。首個細胞療法—列腺癌疫苗Provenge將是CTL019前車之鑒。
Provenge(通用名:Sipuleucel-T)由Dendreon生物制藥公司開發(fā),在治療程序上和CTL019療法非常接近。Provenge的治療分為三個步驟:第一采集患者血樣,并萃取血液中的樹突狀細胞,其次,在Dendreon公司的特殊實驗室里把分離的樹突狀細胞和含有前列腺酸性磷酸酶(PAP)抗原和粒細胞-巨噬細胞集落刺激因子(GM-CSF)的融合蛋白(PA204)中培育48小時。第三,把激活的血液制品(APC8015)再輸入患者體內(nèi)。這些經(jīng)過融合蛋白修飾過的細胞會“誘導”免疫系統(tǒng)靶向并殺死表達PAP的前列腺癌細胞。整個療程需在一個月內(nèi)三次重復上述步驟。兩個雙盲、隨機的三期臨床實驗表明,Provenge療法能顯著延長轉(zhuǎn)移性、激素抵抗型前列腺癌(CRPC)患者的中位生存期。Provenge在2010年4月29日被美國FDA批準用于臨床。
雖然Provenge的臨床效果和安全性受到FDA的肯定,而且也作為一線療法被NCCN治療指南采納。但其治療程序異常復雜,需要為每一位患者單獨制備,相應地收費和成本都非常昂貴。而且和市場競爭者Taxotere相比,療效還不夠明顯優(yōu)越。所以盡管當年Provenge的預測銷售峰值為10億美元,但實際上其銷售越來越難。今年第三季度銷售額只有6千8百萬美元,和上一年同期相比下降了13%,甚至低于預計的一半以上。11月12日,Dendreon公司為節(jié)約成本,裁減了15%的員工,并且把公司的西雅圖生產(chǎn)設施賣給諾華,這樣盡管把成本降至去年4億美元的銷售水平,但對將來的銷售可能會雪上加霜。
所以除了大型的臨床論證以外,諾華CTL019要想取得市場成功還有很長的路要走。首先必須拿到足夠好的臨床數(shù)據(jù),使醫(yī)生相信復雜的治療程序和成本是值得的。其次,在技術(shù)上必須盡量改進其治療難度,提供更好的操作和給藥條件,明顯降低可能因操作失誤造成的危險。第三,改變目前作為搶救療法的地位,臨床上證明CTL019療法能取代骨髓移植,成為ALL和CLL的一線療法,甚至無需化療就可以治愈白血病。總之,CTL019的前途是光明的,但道路是曲折的,是否能成為百億美元的重磅炸彈還有待時間的考證。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。


















 微信號:美中藥源
微信號:美中藥源