
諾華Zykadia(ceritinib)是首個采用中期臨床結(jié)果申報并獲得FDA批準(zhǔn)的“突破性藥物”
作者:呂順
【新聞背景】4月29日,美國FDA通過加速審批通道(accelerated approval)批準(zhǔn)了諾華的二代ALK抑制劑Zykadia(通用名:ceritinib,代號:LDK378)上市,用于治療Xalkori(Crizotinib Capsules,克唑替尼膠囊)治療失敗或不能耐受的ALK陽性的轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者。Zykadia是繼輝瑞的Xalkori之后獲得美國FDA批準(zhǔn)上市的第二個ALK抑制劑,也是首個采用中期臨床結(jié)果申報并獲得FDA批準(zhǔn)的“突破性藥物”,比FDA預(yù)期的批準(zhǔn)時間提前了4個月。
【藥源解析】美中藥源在2月2日曾經(jīng)報道,諾華充分利用了ceritinib獲得美國FDA“突破性藥物”資格帶來的優(yōu)惠,在得到三期臨床結(jié)果之前,直接采用中期的臨床數(shù)據(jù)申報上市(NDA)。事實證明,這個策略再一次獲得成功,而且還比FDA完成藥物評審的預(yù)期日期2014年8月24日,即處方藥用戶付費目標(biāo)日期提前了4個月。Ceritinib是自FDA在2012年開始推行“突破性藥物”評審以來獲得批準(zhǔn)上市的第四款“突破性藥物”,是第一個采用中期臨床結(jié)果申報并獲得FDA批準(zhǔn)的“突破性藥物”。其它三個獲得FDA批準(zhǔn)的“突破性藥物”分別是Gazyva、Imruvica和Sovalldi,但這些都是通過積極的三期臨床結(jié)果才獲得FDA批準(zhǔn)的。
Ceritinib是每天一次口服的膠囊劑,推薦劑量為750毫克/天。支持這次FDA申報的二期臨床實驗招募了163例crizotinib耐藥或不耐受的患者,總應(yīng)答率(ORR)為54.6%,其中包括1.2%的完全應(yīng)答和53.4%的部分應(yīng)答,持續(xù)應(yīng)答時間為7.4個月。不良反應(yīng)包括胃腸道副作用(腹瀉、惡心、嘔吐、腹痛)、肝毒性、間質(zhì)性肺病、QT間期延長、高血糖、心動過緩、以及胚胎胎兒毒性等。
發(fā)現(xiàn)優(yōu)質(zhì)的分子靶點是現(xiàn)代醫(yī)藥工業(yè)的關(guān)鍵,也是新藥開發(fā)的最大瓶頸。EML4-ALK和NPM-ALK融合蛋白是近年來發(fā)現(xiàn)的為數(shù)不多的確認(rèn)靶點之一。但是ALK陽性的患者比例較低,只占非小細(xì)胞肺癌患者總數(shù)的4-5%,而且在2011年美國FDA已經(jīng)批準(zhǔn)了輝瑞的Xalkori上市。即使如此,還是有很多藥廠跟進,目前至少有6個在研項目處于臨床開發(fā)階段。這些以ceritinib為首的二代ALK抑制劑主要針對那些對Xalkori耐藥或不能耐受的晚期非小細(xì)胞肺癌患者。諾華為了爭得二代ALK抑制劑的首創(chuàng)地位,利用了FDA能給予的所有優(yōu)勢,包括“突破性藥物資格”(Breakthrough Therapy designation)、優(yōu)先評審(Priority Review)、加速批準(zhǔn)(accelerated approval)和孤兒藥資格(orphan drug designation)。并成功地通過中期臨床結(jié)果申報上市,且比處方藥用戶付費目標(biāo)的日期提前4個月。
筆者以為Xalkori和Zykadia是創(chuàng)新藥和已知機理新藥開發(fā)的兩個典型。前者的立項依據(jù)是顯然的,代表著個體化治療的重大突破。而后者也解決了前者耐藥或不能耐受的關(guān)鍵問題,符合支付方支付高額藥價的要求。雖然ALK陽性的非小細(xì)胞肺癌患者在美國不足1萬例,考慮到高達(dá)十?dāng)?shù)萬美元的藥價,Xalkori的銷售峰值會接近10億美元,而Zykadia也能得到前者一半的銷售額。
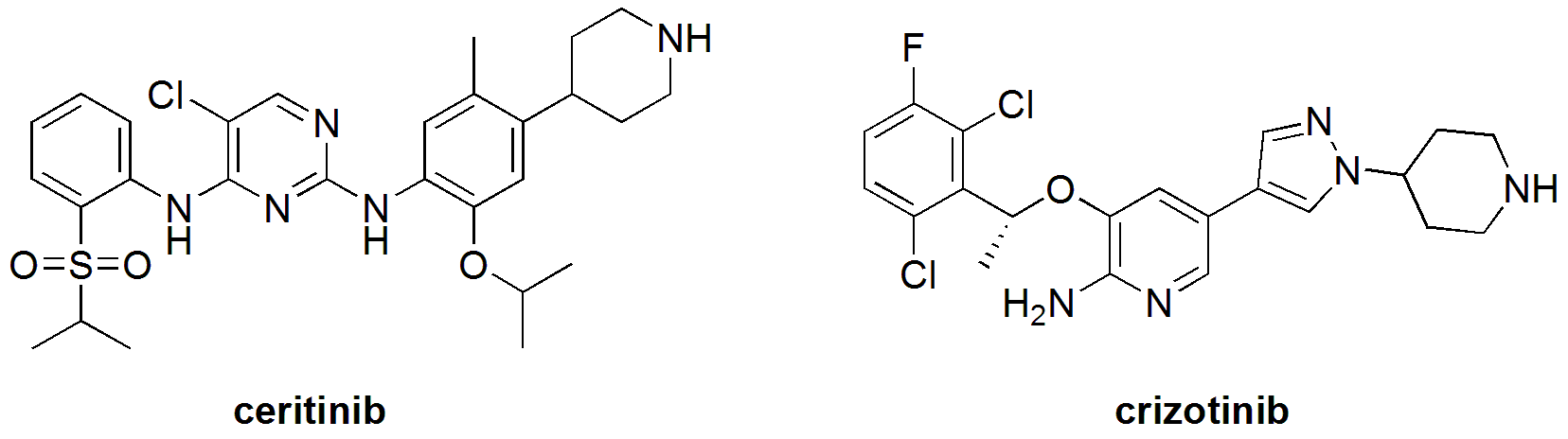
開發(fā)共價鍵/不可逆抑制劑是克服蛋白激酶抑制劑耐藥的一個常見手段。但是ceritinib和克唑替尼(crizotinib)一樣,是可逆性的間變性淋巴瘤激酶(ALK)酪氨酸激酶抑制劑,在細(xì)胞內(nèi)能選擇性地抑制EML4-ALK和NPM-ALK融合蛋白的表達(dá)。如下圖所示,雖然這兩個化合物在化學(xué)結(jié)構(gòu)上有較大差別,但抑制ALK的模式應(yīng)該類似,所以到目前為止還不清楚ceritinib避免耐藥的分子機理。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。


















 微信號:美中藥源
微信號:美中藥源