
腫瘤免疫療法再下一城:安進BiTE單抗Blinatumomab(Blincyto)獲得美國FDA批準上市
作者:呂順
【新聞事件】今天下午,美國FDA批準了又一個革命性的腫瘤免疫療法—雙特異性T-細胞結(jié)合蛋白(BiTE)Blinatumomab(商品名:Blincyto)上市,治療費氏染色體陰性的前體B細胞急性淋巴細胞白血病。Blincyto由生物制藥巨頭安進開發(fā),是第一個上市的BiTE單鏈抗體。
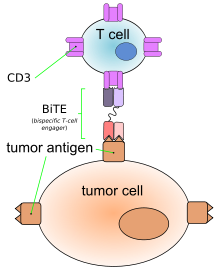
【藥源解析】Blinatumomab最初由德國的Micromet公司研發(fā),在2012年被安進以12億美元的高價收購。如下圖所示,Blinatumomab(AMG103)是利用DNA重組技術(shù)制備的一種雙特異性的單鏈抗體BiTE,通過一條多肽鏈把靶向腫瘤細胞和T細胞表面抗原的兩種單克隆抗體的可變區(qū)連接起來,這樣和其它靶向腫瘤細胞抗原的單抗一樣,Blinatumomab選擇性地靶向B細胞表面抗原CD19,但是和其它抗癌單抗不同的是,Blinatumomab同時特異性地結(jié)合T細胞表面抗原CD3從而激活T細胞,活化的T細胞是殺傷腫瘤細胞的主要效應細胞。因為主要由兩條單鏈抗體連接而成,BiTE的分子量較小(55-60kDa),容易滲透腫瘤組織。同時BiTE缺乏Fc段因而免疫源性較低。2014年7月,Blinatumomab獲得美國FDA的“突破性藥物”資格,治療急性淋巴細胞白血病(ALL)。2014年10月,F(xiàn)DA又給予Blinatumomab“優(yōu)先評審”(priority review)認定,處方費用戶法案日期被定為2015年5月19日。
前體B細胞淋巴細胞白血病(Precursor B-cell lymphoblastic leukemia)是一種進展迅速的白血病,臨床表現(xiàn)為骨髓產(chǎn)生太多B細胞淋巴母細胞。按照美國癌癥研究院的數(shù)據(jù),美國每年大約有6000人診斷為ALL,2014年的死亡人數(shù)大約為1440。在一個有185名費城染色體陰性的前體B細胞ALL患者參與的臨床實驗中,這些患者之前都經(jīng)過治療但都不再表現(xiàn)應答,經(jīng)過Blincyto治療(輸注)四周或以上,有32%的患者在平均6.7個月內(nèi)沒有檢測到腫瘤細胞的存在(完全緩解)。
藥源剛剛討論過,腫瘤免疫療法的進展日新月異,Blinatumomab是美國FDA批準的首個雙特異性T細胞結(jié)合蛋白,為腫瘤的免疫療法又增加了一個上市品種。和免疫哨卡抑制劑Keytruda一樣,Blinatumomab享受了FDA所有的審批優(yōu)惠,包括優(yōu)先評審、加速批準、突破性藥物認定、和孤兒藥。Blinatumomab比預期的批準日期提前了5個多月。因為是加速批準,美國FDA要求廠家繼續(xù)進行Blinatumomab的臨床研究,驗證本品是否能提高這些復發(fā)性或難治性的,費城染色體陰性的前B細胞ALL患者的生存率。同時Blinatumomab伴有警告,提醒患者和醫(yī)護人員一些試用者在該藥早期經(jīng)歷低血壓和呼吸困難(細胞因子釋放綜合征)、短期的思考困難、以及其它神經(jīng)系統(tǒng)副作用。最常見不良事件包括發(fā)熱、頭痛、組織腫脹(外周水腫)、惡心、低鉀、疲勞、便秘、腹瀉和震顫等。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源