首個(gè)抗癌疫苗T-VEC將獲FDA專家小組評(píng)審,在黑色素瘤市場(chǎng)的商業(yè)前景不容樂觀
作者:呂順
【新聞事件】生物制藥巨頭安進(jìn)在2月12日公布,美國(guó)FDA的CTGTAC(細(xì)胞、組織、和基因療法專家委員會(huì))和ODAC(抗腫瘤藥物專家委員會(huì))兩個(gè)專家小組同意評(píng)審其抗腫瘤疫苗talimogene laherparepvec(俗稱T-VEC)的生物制劑許可申請(qǐng)(BLA)。這次兩個(gè)專家小組將在2015年4月29日共同評(píng)審T-VEC的療效和安全性。PDUFA日期也定在10月27日,屆時(shí)FDA將決定是否批準(zhǔn)T-VEC在美國(guó)上市。
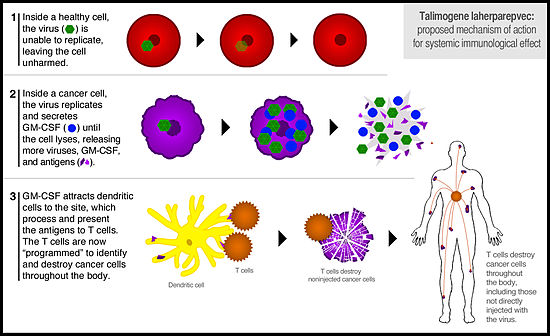
【藥源解析】T-VEC是由皰疹病毒herpes simplex 1通過基因工程改造制備的一種溶瘤病毒。T-VEC通過病灶直接給藥,注射到腫瘤組織后T-VEC起兩方面作用:雖然病毒同時(shí)侵蝕腫瘤細(xì)胞和正常細(xì)胞,但T-VEC只能在腫瘤細(xì)胞中大量復(fù)制并釋放粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)。腫瘤細(xì)胞最終不堪重負(fù)并裂解,而正常細(xì)胞不受影響,這樣起到靶向腫瘤細(xì)胞的目的。二是表達(dá)的GM-CSF激活免疫系統(tǒng)也能起到殺滅腫瘤細(xì)胞的作用。
支持T-VEC本次BLA的主要數(shù)據(jù)來自一個(gè)叫OPTiM的3期臨床實(shí)驗(yàn)。436位IIIB/C或IV期的,未經(jīng)手術(shù)切除的黑色素瘤患者被隨機(jī)以2:1比例分配到T-VEC治療組(n=295)和粒細(xì)胞-巨噬細(xì)胞集落刺激因子(GM-CSF)免疫療法對(duì)照組(n=141)。T-VEC治療組起始病灶注射藥物≤ 4 mL x106 PFU/mL,3周后每2周注射藥物≤ 4 mL x108 PFU/mL。GM-CSF對(duì)照組連續(xù)14天每天皮下注射藥物125 μg/m2,一個(gè)療程28天。結(jié)果發(fā)現(xiàn)T-VEC治療組的持久應(yīng)答率(DRR,定義為完全或部分應(yīng)答持續(xù)至少6個(gè)月以上)是16%,顯著高于對(duì)照組的2%,達(dá)到一級(jí)實(shí)驗(yàn)終點(diǎn)。治療組和對(duì)照組的客觀緩解率分別是26%和6%,其中完全緩解率分別為11%和1%。這個(gè)3期臨床實(shí)驗(yàn)的二級(jí)終點(diǎn)是總生存期,T-VEC治療組總生存期的中位數(shù)是23.3個(gè)月,高于GM-CSF對(duì)照組的18.9個(gè)月,但不具有統(tǒng)計(jì)學(xué)顯著(P = .051)。T-VEC治療組最常見的不良事件有疲勞(50.3%)、畏寒(48.6%)、和發(fā)熱(42.8%)。
T-VEC最初由BioVex研發(fā),安進(jìn)在2011年以4.25億美元現(xiàn)金收購(gòu)了BioVex。如果T-VEC順利上市,這次收購(gòu)的總價(jià)值可能達(dá)到10億美元。
根據(jù)以上隨機(jī)、對(duì)照臨床實(shí)驗(yàn)的結(jié)果,藥源以為T-VEC的療效和安全性是肯定的,但實(shí)驗(yàn)結(jié)果主要受到兩方面的限制。一是T-VEC治療組雖然和對(duì)照組相比能延長(zhǎng)4個(gè)月的生存期,但不具有統(tǒng)計(jì)學(xué)顯著(只是具有延長(zhǎng)生存期的趨勢(shì)),二是T-VEC治療組并沒有和標(biāo)準(zhǔn)療法,尤其是最近批準(zhǔn)上市的PD-1抑制劑直接比較。藥源之前已經(jīng)詳細(xì)討論過,黑色素瘤新藥研發(fā)市場(chǎng)已經(jīng)非常擁擠,自2011年以來FDA已經(jīng)批準(zhǔn)了6個(gè)新分子實(shí)體(NME),它們是Yervoy(CTLA4抑制劑,2011年)、Zelboraf(BRAF抑制劑,2011年)、Tafinlar(BRAF抑制劑,2013年)、Mekinist(MEK抑制劑,2013年)、Keytruda(PD-1抑制劑,2014年)和Opdivo(PD-1抑制劑,2014年)。這些新藥治療黑色素瘤的應(yīng)答率都能和T-VEC相媲美或更好。雖然BRAF和MEK抑制劑使用之后會(huì)產(chǎn)生抗藥性,但包括PD-1抑制劑在內(nèi)的免疫療法既不受變異基因的限制,患者的應(yīng)答時(shí)間也要持久的多。
所以,藥源雖然認(rèn)為T-VEC上市的機(jī)會(huì)依然過半,但在黑色素瘤市場(chǎng)的商業(yè)前景不容樂觀。T-VEC是一個(gè)嶄新機(jī)理的新療法,但生不逢時(shí)。如果順利上市,T-VEC商業(yè)上不僅受到來自BRAF和MEK抑制劑的擠兌,更會(huì)受到療效更好的免疫哨卡抑制劑的打壓。T-VEC在黑色素瘤領(lǐng)域最大的商業(yè)潛力在于其正在進(jìn)行的多個(gè)與其它免疫哨卡抑制劑聯(lián)合用藥的臨床實(shí)驗(yàn)結(jié)果(比如和Yervoy和Keytruda的復(fù)方組合)。FDA在公布專家小組會(huì)議日期之前又給了安進(jìn)額外的3個(gè)月時(shí)間,說明FDA對(duì)T-VEC的現(xiàn)有臨床數(shù)據(jù)并不是很滿意。
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源