
今天FDA批準了第一三共和阿斯列康的HER2 ADC藥物Enhertu (通用名fam-trastuzumab deruxtecan-nxki,中文暫時譯為嗯HER2)用于HER2陽性、至少接受兩種HER2療法的晚期乳腺癌患者。
Continue reading …
今天諾華宣布將終止從Aduro收購STING激動劑ADU-S100的開發(fā),主要是與諾華自己的PD-1抗體spartalizumab、與施貴寶Yervoy的組合療法開發(fā),
Continue reading …
今天美國聯(lián)邦貿易委員會(FTC)宣布經過10個月調查,沒有證據表明羅氏收購Spark會減慢或終止Spark的A型血友病基因療法的開發(fā),也不會影響羅氏自己F8模擬物、雙特異抗體Hemlibra的可及性。FTC驚奇地發(fā)現Spark只是開發(fā)血友病基因療法公司之一,這個收購不僅不會減慢這些藥物的開發(fā)、反而因為與其它廠家競爭會加速。
Continue reading …
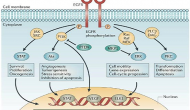
今天AZN和三共在SABCS年會上公布了其HER2 ADC藥物trastuzumab deruxtecan (DS-8201)的一個叫做Destiny-Breast01的二期臨床結果。這個單臂試驗招募184位對已有HER藥物、包括羅氏ADC藥物Kadcyla耐藥的HER2陽性乳腺癌患者
Continue reading …
今天制藥巨頭賽諾菲新掌門人Paul Hudson宣布了其執(zhí)政綱領,主要戰(zhàn)略變更是退出糖尿病、心血管疾病的研發(fā),因此將節(jié)省約22億歐元的研發(fā)開支。已經上市產品將并入通用藥物部門,按成熟產品經營。
Continue reading …
今天Sage宣布其GABA受體陽性調控劑Sage217(又名Zuranolone)在一個叫做Mountain的三期臨床失敗。這個試驗招募581位重癥抑郁(MDD)患者,
Continue reading …
今天Aurinia宣布其環(huán)孢素衍生物voclosporin在一個增生性狼瘡腎炎(LN)三期臨床達到所有一級、二級終點。這個叫做AURORA的試驗招募357位LN患者,在霉酚酸酯和低劑量甾體激素背景上分別使用voclosporin和安慰劑,一級終點位52周腎應答率。
Continue reading …
今天Incyte宣布FDA接受了其FGFR抑制劑pemigatinib在FGFR2融合或易位晚期膽管癌二線以后治療的上市申請。在一個叫做FIGHT-202的二期臨床試驗中pemigatinib在這個人群產生36%應答率、中位應答時間為7.5個月。
Continue reading …
今天麻省總醫(yī)院和哈佛大學科學家在《Cell Reports》發(fā)表一項工作,評價老藥色甘酸鈉在SOD1變異(G93A)驅動小鼠ALS模型的療效。作者發(fā)現腹腔注射色甘酸鈉可以顯著推遲ALS癥狀出現(20小鼠天,相當于人的10年)、增加小鼠肌肉功能(根據一個叫做PaGE 的指標)、并延長雌性小鼠壽命(但對雄性無影響)。表征上色甘酸鈉緩解肌肉去神經、改善運動神經元生存、并降低炎癥細胞因子水平。
Continue reading …
今天FDA批準了Global Blood Therapeutics, Inc. (GBT)的小分子鐮刀細胞疾病(SCD)藥物Oxbryta (通用名voxeloto,曾用名GBT440) 用于12歲以上患者的治療。
Continue reading …
今天在亞洲ESMO年會上加拿大生物技術公司Zymeworks與合作伙伴百濟神州公布了其HER2雙特異抗體ZW25的一個晚期實體瘤一期臨床結果。這個試驗招募69位晚期HER2表達非乳腺癌實體瘤患者
Continue reading …
Alnylam的Givosiran(商品名Givlaari)今天被FDA批準用于一種叫做急性肝卟啉病(AHP)的超級罕見病,成為第二個在美國上市的RNAi藥物。這個批準是根據一個叫做ENVISION的三期臨床試驗,
Continue reading …
今天Bloomberg News報道諾華可能收購開發(fā)PCSK9 RNAi藥物inclisiran的Medicines Company,令今天MDCO股票上揚20%。
Continue reading …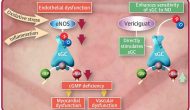
今天默沙東與合作伙伴拜耳宣布其心衰藥物、可溶性鳥苷酸環(huán)化酶(sGC)激動劑Vericiguat在一個叫做VICTORIA的國際多中心三期臨床試驗達到由心衰住院和心血管死亡組成的復合一級終點。
Continue reading …






















 微信號:美中藥源
微信號:美中藥源