集中審評(píng)3.0——藥品價(jià)值評(píng)估的重構(gòu)
作者:胡斌
近日,在美國(guó)“癌癥登月計(jì)劃”的框架下,F(xiàn)DA進(jìn)行了一項(xiàng)組織架構(gòu)方面的創(chuàng)新改革,將抗腫瘤相關(guān)的所有藥物、疫苗、體細(xì)胞治療、醫(yī)療器械的臨床審評(píng)統(tǒng)歸至一個(gè)新組建的“腫瘤卓越研究中心(Oncology Center of Excellence)”下。而按照之前FDA的審評(píng)機(jī)構(gòu)設(shè)置,化藥、單抗等歸為藥物,由藥品評(píng)價(jià)和研究中心(CDER)審評(píng)管理;腫瘤疫苗和體細(xì)胞療法則歸屬生物制品評(píng)價(jià)和研究中心(CBER)管理,分別對(duì)應(yīng)于下轄的疫苗研究和審評(píng)辦公室,以及細(xì)胞、組織和基因治療辦公室;抗腫瘤藥物常用的伴隨診斷試劑則由器械和輻射健康中心(CDRH)管理。
集中審評(píng)是藥品技術(shù)監(jiān)管的自然延伸
簡(jiǎn)單地看,藥品審評(píng)機(jī)構(gòu)是醫(yī)藥產(chǎn)品的考場(chǎng),只有合格通過(guò)才可以順利畢業(yè)。由于大眾認(rèn)為,藥品審評(píng)這項(xiàng)活動(dòng)是對(duì)一款產(chǎn)品的約束性考量,本身并不像研發(fā)、商業(yè)推廣那樣創(chuàng)造明顯的附加價(jià)值,因此往往希望監(jiān)管機(jī)構(gòu)的審評(píng)不要成為阻礙藥品上市的限速步驟。但人們只理解漫長(zhǎng)的研發(fā)數(shù)據(jù)積累,卻要求監(jiān)管方短暫的驚鴻一瞥,這顯然是不公平的。而由于研發(fā)過(guò)程太艱難、不確定性太高,人們盡管在不斷地探索提高研發(fā)效率的模式,也還需要其他努力來(lái)加速藥品的上市進(jìn)程。因此,提高監(jiān)管機(jī)構(gòu)的審評(píng)效率成為一條相對(duì)具有可操作性的途徑。
當(dāng)前美國(guó)、日本、澳大利亞、中國(guó)等國(guó)家都是按照產(chǎn)品的技術(shù)特性來(lái)進(jìn)行監(jiān)管分類(lèi),例如對(duì)化藥、生物制品、器械等等進(jìn)行劃分。這符合人們的認(rèn)知,也便于根據(jù)不同類(lèi)型的產(chǎn)品采取相應(yīng)的技術(shù)要求。生物制品相對(duì)化藥更注重全程控制,并且免疫安全性等問(wèn)題是重要考量,而器械不參與人體代謝,這與藥品有本質(zhì)區(qū)別,注重的質(zhì)量屬性也會(huì)有所差別。因此不難理解,通過(guò)產(chǎn)品特性劃分實(shí)現(xiàn)這種最初級(jí)的集中審評(píng)能夠整合各專(zhuān)業(yè)背景的審評(píng)人員,提高審評(píng)效率。
第二種集中審評(píng)不知是否為中國(guó)特有。在二十一世紀(jì)初,藥品新政實(shí)施、藥企基數(shù)大、資本流入、申報(bào)門(mén)檻低等多因素共同作用下,中國(guó)藥品審評(píng)一直存在排隊(duì)積壓的頑疾。歷史上,中國(guó)藥監(jiān)機(jī)構(gòu)曾采取同品種集中審評(píng)的方式來(lái)提高審評(píng)效率,自去年起的臨床試驗(yàn)數(shù)據(jù)核查等配套措施更是將這一手段的效果發(fā)揮到極致。由于同品種重復(fù)申報(bào)嚴(yán)重,將相同藥品品種集合審評(píng),能夠進(jìn)一步集約化地利用有限的監(jiān)管資源,并且通過(guò)直接的橫向檢閱,更有利于將政策資源向真正高質(zhì)量的藥品傾斜。
按疾病領(lǐng)域建立審評(píng)單元,加快審評(píng)速度
FDA此次將癌癥這一疾病領(lǐng)域作為審評(píng)資源配置的結(jié)構(gòu)單元,非常本質(zhì)地體現(xiàn)出按照對(duì)疾病的獲益來(lái)分配審評(píng)資源的政策趨勢(shì)。與中國(guó)式被動(dòng)的同品種集中審評(píng)不同,這是一次按疾病領(lǐng)域集中審評(píng)的主動(dòng)嘗試。腫瘤是一種復(fù)雜的疾病,近年來(lái)人們?cè)谶@一領(lǐng)域正沿著不同的方向去發(fā)現(xiàn)對(duì)病人創(chuàng)造臨床價(jià)值的手段,各種各樣的新產(chǎn)品正處于爆發(fā)性增長(zhǎng)的階段。FDA此前已在內(nèi)部建立一些機(jī)制來(lái)加強(qiáng)審評(píng)部門(mén)之間對(duì)腫瘤領(lǐng)域相關(guān)問(wèn)題的交流,包括跨部門(mén)的月度會(huì)議、合作研究和出版論文等等。“癌癥登月計(jì)劃”撥出10億美元用于美國(guó)NCI和FDA的癌癥研究,則成為這次FDA腫瘤審評(píng)架構(gòu)調(diào)整的直接原因。
FDA建立的腫瘤審評(píng)中心主要針對(duì)臨床方面,能夠集中藥品、細(xì)胞治療、疫苗、器械等各路專(zhuān)家,在臨床獲益方面對(duì)日益復(fù)雜的抗腫瘤產(chǎn)品提供綜合的評(píng)價(jià),但保持了產(chǎn)品質(zhì)量控制、工藝等方面審評(píng)的獨(dú)立性。例如帶有伴隨診斷試劑的抗腫瘤藥為藥械組合產(chǎn)品,目前的流程是診斷試劑由器械中心審評(píng)管理,藥物歸屬藥品中心,如果將兩方面的專(zhuān)家集中起來(lái),勢(shì)必將壓縮審評(píng)的時(shí)間。又例如安進(jìn)的IMLYGIC是FDA批準(zhǔn)的第一個(gè)治療性抗腫瘤疫苗,審評(píng)經(jīng)驗(yàn)相對(duì)匱乏,在最初的審評(píng)中建議根據(jù)產(chǎn)品的持續(xù)緩解率(DRR)納入加速批準(zhǔn)途徑(Accelerated?Approval)。但抗腫瘤藥加速批準(zhǔn)的一般模式是根據(jù)緩解率等替代終點(diǎn)獲批,上市后進(jìn)一步驗(yàn)證生存期等療效終點(diǎn),而IMLYGIC已顯示對(duì)總生存期不存在改善效果,那么上市后的驗(yàn)證研究就成了一個(gè)偽命題。并且,作為直接在黑色素瘤局部給藥的產(chǎn)品,無(wú)法開(kāi)展與其他常規(guī)安慰劑或?qū)φ账幍谋葘?duì)試驗(yàn),與其他藥物聯(lián)用也無(wú)法體現(xiàn)該藥的單獨(dú)治療獲益,因此FDA的臨床審評(píng)最終將該藥物確定為常規(guī)批準(zhǔn)(Traditional?Approval)。設(shè)想如果在一個(gè)腫瘤審評(píng)中心集合臨床、法規(guī)等方面的專(zhuān)家,并通過(guò)一套有效的機(jī)制進(jìn)行集中審評(píng),將有可能縮短對(duì)IMLYGIC這種創(chuàng)新產(chǎn)品的評(píng)價(jià)時(shí)間。通過(guò)整合臨床審評(píng)資源,企業(yè)真正有價(jià)值的抗腫瘤產(chǎn)品能夠更快地獲批,病人能夠更快享受到最新的治療手段。時(shí)代的大潮是鼓勵(lì)真正對(duì)疾病產(chǎn)生獲益的產(chǎn)品,按照疾病領(lǐng)域來(lái)構(gòu)建審評(píng)資源可以說(shuō)是對(duì)這一潮流的政策強(qiáng)化。但如何從機(jī)制上設(shè)計(jì)一套適用于各種抗腫瘤產(chǎn)品的審評(píng)流程,使這種基于疾病領(lǐng)域構(gòu)建的審評(píng)單元既不流于表面,又能夠保持與各產(chǎn)品質(zhì)量評(píng)估的無(wú)縫銜接,是對(duì)監(jiān)管藝術(shù)的極大挑戰(zhàn)。
新審評(píng)模式是藥品價(jià)值評(píng)估的重構(gòu)
目前尚不知道“腫瘤卓越研究中心”具體如何運(yùn)營(yíng),但按照美國(guó)“癌癥登月計(jì)劃”的意圖,它目的是整合所有可用的各類(lèi)資源,引導(dǎo)投資方向,對(duì)癌癥控制提供真正的獲益。筆者認(rèn)為,在醫(yī)藥產(chǎn)品的生命周期中,外部市場(chǎng)對(duì)產(chǎn)品有三次主要的價(jià)值評(píng)估,即資本的評(píng)估、監(jiān)管機(jī)構(gòu)的評(píng)估和支付方的評(píng)估,而監(jiān)管機(jī)構(gòu)的評(píng)估是承接前后二者的核心所在。監(jiān)管機(jī)構(gòu)對(duì)于某疾病領(lǐng)域醫(yī)藥產(chǎn)品的價(jià)值梳理,能夠在一定程度上使醫(yī)藥研發(fā)創(chuàng)新生態(tài)體系的內(nèi)部協(xié)調(diào)發(fā)展,也為Chorus等“大研發(fā)”模式和福布斯專(zhuān)欄作家Matthew Herper提出的“大支付”模式提供了強(qiáng)有力的輔助。
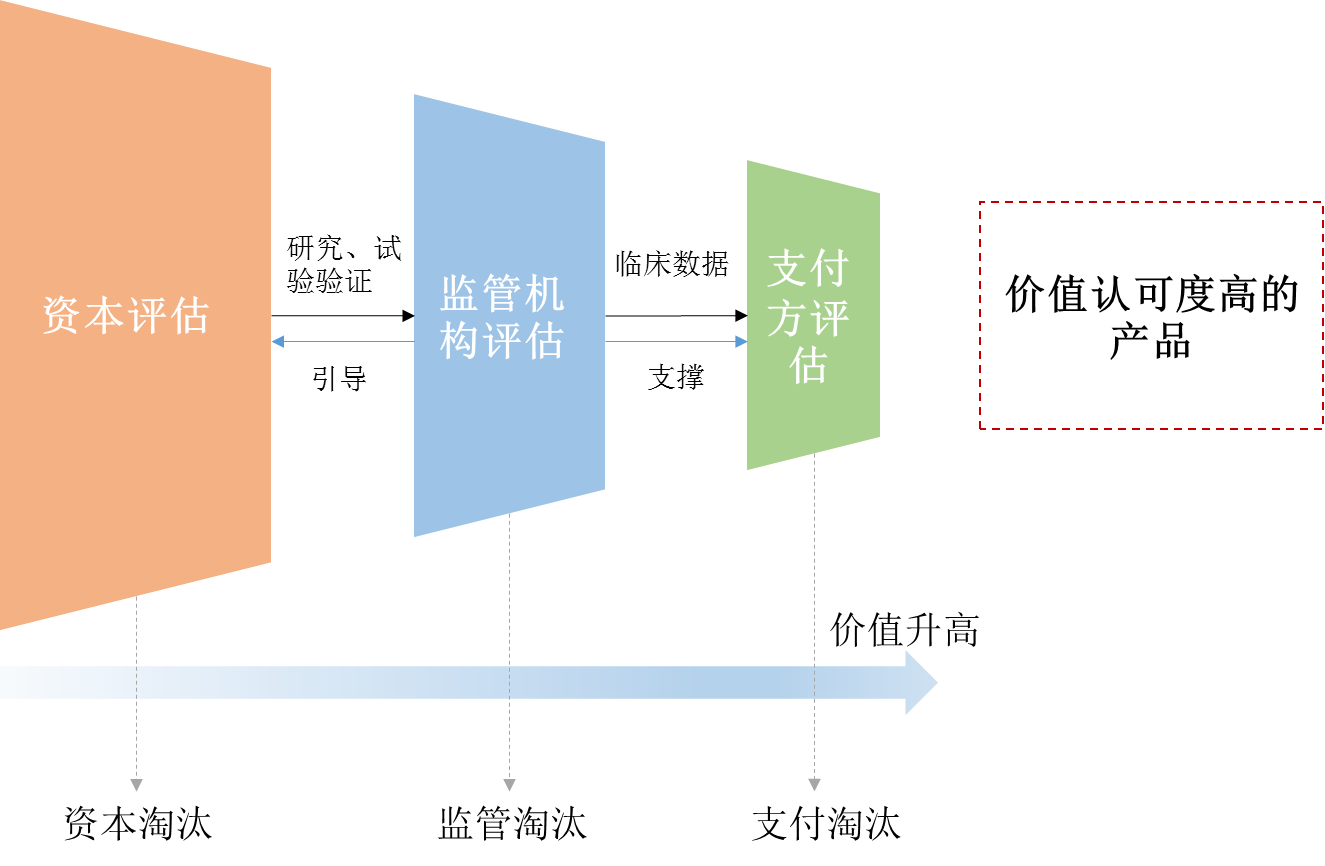
沿著價(jià)值評(píng)估的鏈條,未來(lái)能夠獲得更多政策資源、產(chǎn)生更多經(jīng)濟(jì)效益的必將是具有高品質(zhì)研發(fā)實(shí)力的“發(fā)動(dòng)機(jī)”型企業(yè)和有助于產(chǎn)品通過(guò)價(jià)值評(píng)估考驗(yàn)的“鏈條”型企業(yè)。前者包括具備資源整合能力的規(guī)模化藥企巨頭、具備創(chuàng)新突破能力的小型生物技術(shù)公司等,后者為優(yōu)質(zhì)CRO、原輔料供應(yīng)商、經(jīng)營(yíng)商等。但癌癥領(lǐng)域的產(chǎn)品豐富,精準(zhǔn)醫(yī)療的概念和各種有效的治療手段已為人們開(kāi)啟了前進(jìn)的道路,進(jìn)而才借著政策的順風(fēng)催生出“腫瘤卓越研究中心”這一產(chǎn)物,該模式對(duì)于其他疾病是否適用,還有待商榷。
推薦閱讀
雞肋陷阱:IL17受體A抗體brodalumab價(jià)廉物不美
聚焦生物類(lèi)似藥(2):生物類(lèi)似藥 VS. 化學(xué)仿制藥
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書(shū)面授權(quán)。★更多深度解析訪問(wèn)《美中藥源》~
★ 請(qǐng)關(guān)注《美中藥源》微信公眾號(hào) ★

發(fā)表評(píng)論
要發(fā)表評(píng)論,您必須先登錄。


















 微信號(hào):美中藥源
微信號(hào):美中藥源