
2019年FDA批準48款新藥、高調結束了21世紀第二個10年。這10年是制藥工業(yè)復蘇的10年,不僅新藥產(chǎn)出數(shù)量遠超第一個10年、而且很多新技術進入成熟期。基因療法、細胞療法、RNAi、ASO、雙特異抗體、ADC這些2009年時還是科幻或非主流的技術現(xiàn)在已經(jīng)都有不止一個藥物上市,基因編輯、蛋白降解等當時做夢也想不到的技術也已經(jīng)開始了人體臨床試驗。
Continue reading …
今天日本制藥企業(yè)安斯泰來宣布將以1.2億現(xiàn)金、總值6.65億收購美國生物技術公司Xyphos Biosciences。Xyphos 的技術平臺叫ACCEL,
Continue reading …
今天Spectrum Pharmaceuticals (SPPI)公布了其外顯子20插入變異EGFR抑制劑poziotinib在一個叫做ZENITH20的二期臨床部分結果。
Continue reading …
今天FDA批準了第一三共和阿斯列康的HER2 ADC藥物Enhertu (通用名fam-trastuzumab deruxtecan-nxki,中文暫時譯為嗯HER2)用于HER2陽性、至少接受兩種HER2療法的晚期乳腺癌患者。
Continue reading …
今天諾華宣布將終止從Aduro收購STING激動劑ADU-S100的開發(fā),主要是與諾華自己的PD-1抗體spartalizumab、與施貴寶Yervoy的組合療法開發(fā),
Continue reading …
今天AZN和三共在SABCS年會上公布了其HER2 ADC藥物trastuzumab deruxtecan (DS-8201)的一個叫做Destiny-Breast01的二期臨床結果。這個單臂試驗招募184位對已有HER藥物、包括羅氏ADC藥物Kadcyla耐藥的HER2陽性乳腺癌患者
Continue reading …
今天Incyte宣布FDA接受了其FGFR抑制劑pemigatinib在FGFR2融合或易位晚期膽管癌二線以后治療的上市申請。在一個叫做FIGHT-202的二期臨床試驗中pemigatinib在這個人群產(chǎn)生36%應答率、中位應答時間為7.5個月。
Continue reading …
今天在亞洲ESMO年會上加拿大生物技術公司Zymeworks與合作伙伴百濟神州公布了其HER2雙特異抗體ZW25的一個晚期實體瘤一期臨床結果。這個試驗招募69位晚期HER2表達非乳腺癌實體瘤患者
Continue reading …
今天FDA通過加速審批通道批準了百濟神州的BTK抑制劑Brukinsa (通用名zanubrutinib)用于治療至少失敗一種療法的套細胞淋巴瘤。這個審批是根據(jù)一個86人參與的單臂臨床試驗結果,Brukinsa在這個人群的應答率為84%、中值應答時間為19.5個月。
Continue reading …
今天在SITC年會上匹斯堡大學的Kirkwood教授匯報了Checkmate Pharmaceutical的TLR9激動劑CMP-001單方或與K藥組合在K藥耐藥惡黑患者的一個二期臨床結果。
Continue reading …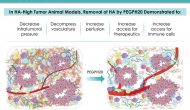
今天美國生物技術公司Halozyme宣布其透明質酸酶制劑PEGPH20在一個叫做HALO-301的胰腺癌三期臨床失敗。這個試驗在吉西他濱和ABRAXANE?背景上比較PEGPH20與安慰劑作為晚期胰腺癌一線藥物對OS的影響,
Continue reading …
今天美國生物技術公司Mirati在 EORTC-NCI-AACR年會上公布了其G12C變異Kras藥物MRTX849的首批臨床數(shù)據(jù)。在6位使用最高劑量MRTX849(600毫克一日兩次)的NSCLC患者中有3位達到部分應答、但有2例尚未經(jīng)中心機構確認。四位高劑量CRC患者有一例應答、并已經(jīng)確認。首次消息影響MRTX股票上揚22%。
Continue reading …























 微信號:美中藥源
微信號:美中藥源