
諾華ribociclib因療效顯著被提前終止,輝瑞Ibrance之競爭對手呼之欲出?
【新聞事件】:諾華CDK4/6抑制劑ribociclib(LEE011)在一個叫做MONALEESA-2的3期臨床試驗中,和來曲唑聯(lián)合使用相比安慰劑對照組因顯著延長患者的無進展生存期(PFS)而被提前終止。MONALEESA-2是一項隨機、雙盲、安慰劑對照的關(guān)鍵3期臨床試驗,在全球294個中心的668位激素受體陽性(HR+)和人表皮生長因子受體2陰性(HER2-)的絕經(jīng)后婦女患者中進行。一級實驗終點是無進展生存期(PFS),次要終點有總生存期(OS)、客觀應(yīng)答率(ORR)、生活質(zhì)量、安全性和耐受性。一個獨立數(shù)據(jù)監(jiān)測委員會日前按照預(yù)定計劃對MONALEESA-2進行了中期數(shù)據(jù)分析發(fā)現(xiàn),ribociclib聯(lián)合來曲唑和安慰劑對照組(聯(lián)合來曲唑)相比顯著改善這些患者的無進展生存期(PFS)。不良事件與之前報道的結(jié)果相似。雖然該試驗因倫理原因被終止,對照組患者轉(zhuǎn)移到治療組,但將繼續(xù)收集患者的總生存期數(shù)據(jù)。這個中期臨床結(jié)果的詳細(xì)數(shù)據(jù)會在相關(guān)醫(yī)學(xué)會議上報道。
【藥源解析】:之前我們多次討論過,鑒于細(xì)胞周期蛋白依賴性激酶(CDK)對正常細(xì)胞的調(diào)控功能以及制備高選擇性CDK抑制劑的技術(shù)挑戰(zhàn),CDK抑制劑類的新藥開發(fā)一直緩慢。直到2009年輝瑞才全速推進其口服、選擇性的CDK4/6抑制劑palbociclib的臨床開發(fā),并在2015年2月3日獲得FDA加速批準(zhǔn)上市(商品名:Ibrance),推出臨床上首個CDK4/6抑制劑。結(jié)果Ibrance獲得巨大商業(yè)成功,上市當(dāng)年的銷售就高達7.23億美元。而且Ibrance今年的銷售繼續(xù)高歌猛進,第一季度又給輝瑞帶來4.29億美元收入,迅速進入重磅產(chǎn)品序列。多個機構(gòu)預(yù)測Ibrance的銷售峰值將超過45億美元。
隨著Ibrance的商業(yè)成功,開發(fā)選擇性的CDK4/6抑制劑的競爭也變得前所未有的激烈。目前最有希望和輝瑞Ibrance競爭的在研產(chǎn)品有諾華的ribociclib(LEE011)和禮來的abemaciclib。除此之外,G1 Therapeutics的G1T38也針對Ibrance相同的適應(yīng)癥,試圖開發(fā)所謂的“best-in-class”CDK4/6抑制劑。當(dāng)然輝瑞的Ibrance至少在HR+/HER2-晚期乳腺癌這個適應(yīng)癥上遙遙領(lǐng)先,并繼續(xù)鞏固其在相關(guān)患者人群的領(lǐng)先地位,那么其它“選手”能對Ibrance構(gòu)成威脅,蠶食一部分的CDK4/6抑制劑市場嗎?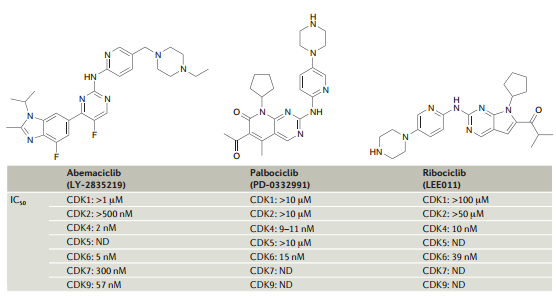
上圖是abemaciclib、palbociclib(Ibrance)和ribociclib三個CDK4/6抑制劑的化學(xué)結(jié)構(gòu)和體外活性和選擇性。從這些初步體外數(shù)據(jù)來看Ibrance、ribociclib、和abemaciclib的區(qū)別不大,禮來的abemaciclib體外活性稍高但在臨床上也不應(yīng)該顯示明顯區(qū)分。事實上到目前為止還未有數(shù)據(jù)表明ribociclib或abemaciclib在這個人群顯示和Ibrance相比的任何療效或安全性優(yōu)勢。根據(jù)一個用于申報的,有165位ER陽性、HER2陰性晚期乳腺癌患者參與的2期臨床結(jié)果,Ibrance/來曲唑聯(lián)合治療組相比來曲唑單藥組無進展生存期(PFS)從10.2個月延長至20.2個月,但中期分析顯示總生存率并未改善。ribociclib或abemaciclib同樣沒有總生存期數(shù)據(jù)。據(jù)稱禮來的abemaciclib和輝瑞、諾華產(chǎn)品相比潛在的臨床區(qū)分最大,主要表現(xiàn)在腸胃道副作用相對較小,有望能每天給藥,提高CDK4/6抑制劑的臨床療效。而且和其它兩個產(chǎn)品相比骨髓抑制也更少。不過這些結(jié)果都不具有統(tǒng)計學(xué)顯著。
雖然諾華ribociclib的3期臨床因療效顯著被提前終止,即使馬上申報其上市時間也要比輝瑞晚2年,再加上和Ibrance相比未有明顯臨床區(qū)分,除非將來在總生存期方面顯示明顯優(yōu)勢否則很難對Ibrance的市場銷售造成威脅。和諾華相比禮來的abemaciclib情況稍好,但也不大可能蠶食Ibrance現(xiàn)有的較大市場份額。因此,palbociclib的paloma-3實驗、ribociclib的MONALEESA-2實驗、以及abemaciclib的Monarch2臨床結(jié)果是這3個CDK4/6雙抑制劑在乳腺癌這個適應(yīng)癥領(lǐng)域角逐的關(guān)鍵。
以上開發(fā)CDK4/6抑制劑的市場競爭也是以me-too/me-better藥物開發(fā)為代表的,沒有明顯臨床區(qū)分藥物開發(fā)的一個縮影。隨著支付方進一步主宰處方藥的使用,這部分產(chǎn)品將進一步受到市場擠壓。藥源最近報道即使象Opdivo這樣的明星產(chǎn)品也會遭到支付方的拒絕(見“NICE拒絕Opdivo,支付政策決定新藥產(chǎn)出” )。因此,相同機制或me-too藥物的開發(fā)要充分利用癌癥不是一種疾病這個先天條件,充分利用生物標(biāo)記和first-in-class產(chǎn)生一些臨床區(qū)分。比如羅氏的抗PD-L1抗體雖然比Opdivo和Keytruda晚上市2年,但在晚期膀胱癌這個適應(yīng)癥率先上市(見“FDA批準(zhǔn)首個PD-L1抗體atezolizumab”)。更重要的是atezolizumab能充分利用羅氏龐大的抗腫瘤產(chǎn)品線和更多的產(chǎn)品開發(fā)聯(lián)合用藥。G1 Therapeutics也從降低化療對骨髓和免疫系統(tǒng)損傷的另一個方面著手,開發(fā)其G1T28的不同適應(yīng)癥。當(dāng)然,因為這是開發(fā)全新適應(yīng)癥,雖然CDK4/6抑制劑已經(jīng)被證實治療HR+/HER2-晚期乳腺癌有效,但對其它適應(yīng)癥并沒有多少指導(dǎo)作用,仍然將面臨首創(chuàng)藥物的大多數(shù)風(fēng)險。
推薦閱讀
從Ibrance(palbociclib)獲FDA批準(zhǔn)、G1 Therapeutics第二輪融資,談me-too CDK4/6抑制劑開發(fā)
CDK4/6抑制劑的另類應(yīng)用,G1 Pharmaceuticals獲4700萬C輪支持
美中藥源原創(chuàng)文章,轉(zhuǎn)載注明出處并添加超鏈接,商業(yè)用途需經(jīng)書面授權(quán)。★更多深度解析訪問《美中藥源》~
★ 請關(guān)注《美中藥源》微信公眾號 ★

One Response to 諾華ribociclib因療效顯著被提前終止,輝瑞Ibrance之競爭對手呼之欲出?
發(fā)表評論
要發(fā)表評論,您必須先登錄。

















 微信號:美中藥源
微信號:美中藥源
Pingback: 聯(lián)合起來對抗耐受:RapaLink-1 | 美中藥源