今天FDA批準(zhǔn)了羅氏的雙特異抗體emicizumab (又名ACE910,商品名Hemlibra),用于治療產(chǎn)生VIII因子抗體的A型血友病。
Continue reading …
今天獨(dú)角獸生物技術(shù)公司Moderna宣布其治療性腫瘤疫苗mRNA-4157將與默沙東的PD-1抗體Keytruda聯(lián)用開始一期臨床。
Continue reading …
今天FDA批準(zhǔn)了大塚制藥的Abilify MyCite(阿立哌唑芯片片劑)用于治療精神分裂、雙重人格障礙、重度抑郁。這個產(chǎn)品在阿立哌唑片劑中加入一個沙粒大小的電子芯片(由Proteus Digital Health公司生產(chǎn))
Continue reading …
借著免疫療法協(xié)會年會東風(fēng),Cancer Research Institute(CRI)統(tǒng)計了現(xiàn)在PD-1藥物研發(fā)情況。除了已經(jīng)上市的5個PD-1藥物和正在臨床三期研究的三個,現(xiàn)在臨床、臨床前還有近160個PD-1藥物在開發(fā)中,其中9個已經(jīng)進(jìn)入二期臨床。CRI統(tǒng)計現(xiàn)在有1502個PD-1藥物臨床,其中1105個是組合療法試驗(yàn)。
Continue reading …
今天Sage Therapeutics公布了其GABA受體調(diào)控劑brexanolone(別孕烯醇酮,又名SAGE-547)的產(chǎn)后抑郁三期臨床結(jié)果。
Continue reading …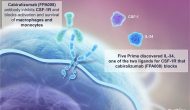
今天Five Prime公布了其CSF1R抗體cabiralizumab (FPA008)與Opdivo聯(lián)用的部分一期臨床結(jié)果。此組合在二線胰腺癌患者產(chǎn)生10%客觀應(yīng)答、6個月疾病控制率為13%。但43%的患者發(fā)生3-5級不良反應(yīng),令投資者大失所望。今天FPRX股票下滑40%。
Continue reading …
今天FDA在五月拒絕Therapeutic MD的止痛藥TX-004HR后宣布將受理其上市申請,因此放棄了對這個產(chǎn)品一年安全性數(shù)據(jù)的要求。
Continue reading …
今天《自然藥物發(fā)現(xiàn)》雜志發(fā)表一篇由福泰科學(xué)家發(fā)表的一篇綜述文章,回顧過去20年(1996-2016)制藥工業(yè)追逐的生物機(jī)理與疾病。
Continue reading …
今天NEJM發(fā)表了Ionis和百健的SMN2反譯RNA藥物Nusinersen(商品名SPINRAZA)和Avexis的SMN1基因療法AVXS-101在兒童脊髓性肌肉萎縮癥(SMA)的兩個臨床試驗(yàn)結(jié)果。Nusinersen已經(jīng)在美國上市,今天發(fā)表的是122名兒童參與的三期臨床結(jié)果。
Continue reading …
這一期的《自然化學(xué)生物學(xué)》發(fā)表了一篇原葛蘭素科學(xué)家、現(xiàn)在北卡大學(xué)任教的Frye教授撰寫題為“Target class drug discovery”的文章,提出靶點(diǎn)為中心新藥研發(fā)最好不要每個靶點(diǎn)單打獨(dú)斗,而是對整個靶點(diǎn)家族進(jìn)行系統(tǒng)規(guī)劃。
Continue reading …
今天Stemline公布了其樹狀細(xì)胞腫瘤(BPDCN)藥物、免疫毒素SL-401的一個關(guān)鍵二期臨床的頂級分析結(jié)果,詳細(xì)結(jié)果將在12月的ASH年會公布。
Continue reading …
今天諾華宣布將以39億美元、溢價44%(相對于9月末謠言傳出時價格)收購法國生物技術(shù)公司Advanced Accelerator Applications (AAAP)。
Continue reading …
今天新基公布了第三季度業(yè)績,結(jié)果遭到投資者的嚴(yán)厲懲罰。雖然比去年同期銷售上揚(yáng)11%,但比投資者預(yù)期值低4%。更嚴(yán)重的是今天更新的2020年銷售預(yù)測也比上個季度的預(yù)測數(shù)據(jù)低5-10%。主要原因是銀屑病藥物Otezla銷售不盡人意,而被寄予厚望的克羅恩疾病藥物、口服RNA藥物mongersen的十幾億銷售預(yù)測現(xiàn)在看也難以實(shí)現(xiàn)。
Continue reading …
今天FDA拒絕了PTC Therapeutic的小分子杜氏營養(yǎng)肌不良癥(DMD)藥物ataluren(商品名Translarna)的上市申請。FDA要求PTC至少提供一個設(shè)計合理的陽性臨床試驗(yàn)結(jié)果,并提出一些CMC疑問。這個申請是根據(jù)兩個失敗臨床的亞組分析,今年9月專家組以10:1拒絕支持ataluren上市申請,唯一贊成票來自一個病人代表。由于未知因素今天股票反而上揚(yáng)7%。

今天吉利德公布了其NASH藥物、別構(gòu)ACC2抑制劑GS-0976的一個二期臨床結(jié)果。這個試驗(yàn)招募126位病人,
Continue reading …
昨天新基宣布將終止其克羅恩疾病藥物、口服SMAD7反義RNA藥物mongersen的兩個三期臨床試驗(yàn)(RESOLVE 和其延伸試驗(yàn)SUSTAIN ),另一個尚未招募病人的三期臨床DEFINE 也將取消。
Continue reading …
今天強(qiáng)生宣布將終止其IL6抗體、關(guān)節(jié)炎藥物sirukumab的臨床開發(fā),并停止招募另一個重要在研藥物、CD123抗體talacotuzumab(AML)的一個關(guān)鍵二/三期臨床試驗(yàn)。
Continue reading …
今天羅氏宣布將與Warp Drive Bio合作開發(fā)新型抗生素。羅氏將支付8700萬首付和潛在3億美元里程金,WDB則將利用他們獨(dú)特的技術(shù)平臺尋找全新骨架抗生素。
Continue reading …



















 微信號:美中藥源
微信號:美中藥源