
今天美國FDA授予諾華的CDK4/6雙抑制劑ribociclib(LEE011)的加速評審地位(priority review),用于和來曲唑聯(lián)用,作為一線用藥治療HR陽性/ HER2陰性的絕經(jīng)后婦女的晚期乳腺癌。
Continue reading …
今天輝瑞宣布將終止其PCSK9抗體bococizumab的開發(fā),正在進(jìn)行的兩個三期臨床SPIRE1和SPIRE2將停止,雖然這兩個臨床已經(jīng)完成病人招募(共27000人,完成招募就是大工程)。
Continue reading …
今天羅氏宣布將以500萬美元的白菜價將其PI3K抑制劑GDC-0084轉(zhuǎn)讓給澳大利亞生物技術(shù)公司Novogen。這個產(chǎn)品已經(jīng)完成了一個一期臨床并會很快開始二期。
Continue reading …
今天日本制藥企業(yè)安斯泰來宣布將以4.6億美元首付、9.6億潛在里程金收購德國生物技術(shù)公司Ganymed。Ganymed的核心資產(chǎn)Claudin18.2抗體IMAB362曾是今年ASCO的最大黑馬。在胃癌二期試驗中比標(biāo)準(zhǔn)化療顯著延長生存期(13.2 對8.4 個月),
Continue reading …
今天阿斯列康免疫療法PD-L1抗體durvalumab與CTLA4抗體tremelimumab組合在兩個頭頸癌臨床試驗中發(fā)生病人出血事件,F(xiàn)DA因此部分叫停這兩個分別叫做KESTREL 和EAGLE的臨床試驗,即停止招募新病人但已招募病人繼續(xù)。
Continue reading …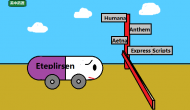
今天美國最大保險醫(yī)療公司之一Humana宣布將限制支付Sarepta Therapeutics的DMD藥物Eteplirsen(商品名Exondys 51)。
Continue reading …
今天美國生物技術(shù)公司Dipexium宣布其多肽抗生素Locilex (0.8% pexiganan 軟膏)在兩個糖尿病足病三期臨床失敗,但具體數(shù)據(jù)沒有公布。
Continue reading …
默沙東在今天下午宣布,其明星抗腫瘤免疫療法Keytruda(通用名:pembrolizumab)的補(bǔ)充生物制劑許可申請(sBLA)獲得FDA批準(zhǔn),
Continue reading …
今天Aduro Biotech宣布其李斯特細(xì)菌平臺(LADD)因有病人感染李斯特菌而被FDA叫停,Aduro將暫時停止招募新病人,但已入組病人將繼續(xù)(除了那個感染患者)。
Continue reading …
今天吉利德科學(xué)公布了其ASK1抑制劑selonsertib(GS4997)的三個二期臨床結(jié)果。這個化合物在肺動脈高血壓和糖尿病腎病的二期臨床徹底失敗,但在一個72人的NASH二期臨床顯示一定療效信號。
Continue reading …
昨天FDA批準(zhǔn)了羅氏的PD-L1抗體Tecentriq(通用名atezolizumab)用于所有化療、靶向療法失敗的二線肺癌治療,并不受PD-L1水平限制。
Continue reading …
今天Medicine’s Company宣布其PCSK9 siRNA藥物PCSK9si(ALN-PCSsc)在一個二期臨床“顯著超出預(yù)期”的療效并耐受性良好,但具體數(shù)據(jù)將在下個月的美國心臟協(xié)會年會上公布
Continue reading …
今天LifeSciVC的著名博主Bruce Booth發(fā)表一篇博文分析2011-2016年FDA批準(zhǔn)藥物的發(fā)源與完成廠家。這五年FDA共批準(zhǔn)170個新分子藥物,其中65%從小生物技術(shù)公司開始,但是69%是由最大的25個藥廠最后完成報批上市。
Continue reading …
今天英國生物技術(shù)公司Adaptimmune宣布其卵巢癌TCR療法NY-ESO SPEAR在一個I/IIa期臨床中未能產(chǎn)生任何應(yīng)答。這個針對腫瘤抗原NY-ESO-1的TCR療法使用環(huán)磷酰胺作為預(yù)處理,
Continue reading …
今天《J. Med. Chem.》發(fā)表一篇文章討論如何培養(yǎng)未來的藥物化學(xué)家。文章作者M(jìn)ichael Rafferty是堪薩斯大學(xué)教授,但此人曾是輝瑞的藥化領(lǐng)導(dǎo)人之一,所以對大學(xué)和制藥界都有相當(dāng)?shù)睦斫狻?/p>
Continue reading …
昨天美國生物技術(shù)公司Alnylam宣布叫停revusiran一個叫做ENDEAVOUR的三期臨床開發(fā)。在這個206位轉(zhuǎn)甲狀腺素蛋白淀粉樣變性心肌損傷病人參與的臨床試驗中有18位病人死亡,中期分析顯示用藥組死亡人數(shù)偏多,療效也不顯著。
Continue reading …


















 微信號:美中藥源
微信號:美中藥源