
11月26日,Durata制藥公司宣布美國FDA已接受其新抗生素 Dalvance(通用名:dalbavancin hydrochloride,達巴萬星鹽酸鹽)注射劑的新藥申請,并作優(yōu)先審查,將于2014年5月26日作出決定。Dalvance用于治療包括MRSA (耐甲氧西林金黃色葡萄球菌)等革蘭氏陽性細菌感染引起的急性細菌性皮膚或皮膚結構感染(ABSSSI)。
Continue reading …
【新聞背景】2013年11月22日,美國FDA要求總部位于加州并有谷歌背景的一家基因測序公司23andMe Inc.停止銷售其唾液收集套件、個人基因測序服務(PGS)、健康風險評估、以及其它未被FDA批準的檢測業(yè)務。
Continue reading …
【新聞事件】:“新鮮指數(shù)”衡量近期上市產品在一個公司銷售中的比重。由于大藥廠的銷售相對穩(wěn)定,“新鮮指數(shù)”高意味著近期上市的品種具有較強的市場競爭力。在2013的前9個月,強生銷售的23.4%來自2010年以后批準上市的產品,其中抗癌藥物Zytiga貢獻12億美元。前十名如下表。
Continue reading …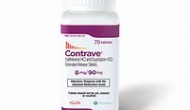
【新聞事件】:今天Orexigen宣布其減肥藥Contrave在一個叫做LIGHT的3期臨床中顯示安全性良好,可望明年上市。這個實驗并未完成,今天的公告是階段性分析,但FDA以前同意如果這個分析達到FDA要求則可以上市contrave。
Continue reading …
不要說在歐美國家,即使在國內對中藥的評價似乎也呈兩極分化。所以,從某種角度上說中藥登陸歐美市場除了擴大市場以外更是政治使命。雖然不具可比性,中藥何時才能登陸歐美市場的問題有點象何時中國人獲得理科諾貝爾獎一樣。
Continue reading …
【新聞背景】2013年11月22日,美國FDA批準了強生的Olysio(通用名:simeprevir,曾用名:TMC435)上市,用于和聚乙二醇干擾素α和利巴韋林聯(lián)用,治療基因I型的慢性丙型肝炎病毒感染。
Continue reading …
首先一點背景介紹。直到最近十幾二十年,藥物基礎研究和應用研究的合作不算多。基礎科學在發(fā)現(xiàn)新知識,應用科學在尋找新產品。在醫(yī)藥領域,80年代前二者不具備合作的條件,基礎研究的成果和藥物研發(fā)相差太遠。工業(yè)界用整體動物篩選、優(yōu)化藥物,教授們還在整理生物、生理、病理的基本知識。
Continue reading …
11月19日,以波士頓布里格姆婦女醫(yī)院的心臟病專家Robert Giugliano博士為首的研究人員在達拉斯舉行的美國心臟協(xié)會科學會議上介紹,第一-三共公司研發(fā)的一種新抗凝藥Edoxaban(依度沙班)在一項大型后期臨床實驗中,和廣泛使用的華法林相比能更有效地預防血液凝塊和中風,而且產生大出血的風險也明顯低于法華林。
Continue reading …
【新聞事件】:今天Amicus和葛蘭素治療宣布終止治療Fabry病的口服藥物Amigal (migalastat)的合作。Amicus將完全負責開發(fā)、上市這個產品,但GSK可能會得到銷售提成。GSK將在這個產品繼續(xù)投入300萬美元。
Continue reading …
據路透社11月18日報道,現(xiàn)已被廣泛使用的新抗凝劑Pradaxa(Dabigatran Etexilate Capsules,達比加群酯膠囊。在我國注冊名:泰畢全)的一種實驗性解藥在健康志愿者中進行的早期試驗中療效明顯,為Pradaxa使用過程中出現(xiàn)緊急情況(出血)時逆轉其血液稀化作用帶來了希望。
Continue reading …
【新聞事件】:今天Vertex宣布以1.52億美元將其丙肝藥物Invicek轉讓給銷售伙伴楊森,從2014年起將不再享受任何銷售提成。Incivek成為史上最曇花一現(xiàn)的重磅藥物。
Continue reading …
艾美仕醫(yī)療信息研究所(IMS Health Inc.)2013年11月19日發(fā)布年度報告,指出全球醫(yī)療市場從腫瘤到心血管疾病等呈穩(wěn)步增長趨勢,預計到2014年底,全球處方藥銷售額的總和高達1萬億美元。不僅如此,全球醫(yī)藥開支在今后的五年內將以每年百分之三到六的速率遞增,預計至2017年全球醫(yī)藥開支將高達1.2萬億美元。
Continue reading …
【新聞事件】:今天默克公布了其在研重要藥物PD-1抑制劑MK-3475在皮膚惡性黑色素瘤患者的一期臨床結果。在1年的實驗中,患者的生存率達到81%,41%的患者腫瘤縮小,高劑量組腫瘤縮小的比例達到51%。在135位病人中,10人達到完全應答。88%的完全或部分應答患者無惡化跡象。
Continue reading …
【新聞背景】據彭博社消息,美國FDA在評審安進、賽諾菲、輝瑞等公司的新一代心血管藥物的新藥申報時(NDA)不要求提供藥物對心血管病發(fā)生風險甚至死亡的臨床數(shù)據。據美國FDA藥物評審和研究部副主任埃里克?科爾曼(Eric Colman)說,F(xiàn)DA在審批PCSK9抑制劑時還是參照過去標準,考察藥物對降低膽固醇、血壓以及炎癥等指標,而不要求完成PCSK9抑制劑對心血管風險的完整實驗結果。
Continue reading …
作者:路人丙 自發(fā)現(xiàn)磺胺藥物以來人們一直在試圖發(fā)明新技術來提高發(fā)現(xiàn)新藥的效率。從早期的抗生素篩選,到Leo S […]
Continue reading …
【新聞事件】2013年11月12日下午,美國心臟協(xié)會(AHA)和美國心臟病學院(ACC)發(fā)布何時使用降低低密度脂蛋白膽固醇(“壞”膽固醇或LDL)藥物的新指南。新指南不再采用過去的以LDL值為分層診斷的切點,而是采用綜合指標,評估患者心血管疾病發(fā)生的風險。新的指南反映了新藥研發(fā)從血液指標向治療疾病移動的大趨勢。
Continue reading …
【新聞事件】:今天 FDA 通知Sarepta Therapeutics 不要提交其杜氏肌營養(yǎng)不良癥藥物eteplirsen的加速審批申請因為FDA高度懷疑他們只有12人的二期臨床數(shù)據是否能在三期臨床重復。受此影響, Sarepta 股票下跌 57% 至每股15.62美元。 FDA要求Sarepta做一個安慰劑對照的三期臨床而Sarepta希望用無non-exon 51 跳躍患者作為對照。
Continue reading …


















 微信號:美中藥源
微信號:美中藥源